
- •7. Внутренняя энергия термодинамической системы.Изменение внутренней энергии.Энтальпия
- •Энтальпия
- •8. Теплоемкость газа. Виды теплоемкости. Уравнение Майера
- •9. Сушность первого закона термодинамики. Аналитическое выражение первого закона термодинамики.
- •10. Последовательность и обьем расчета термодинамических процессов
- •11. Определение, осуществление и исследование основных термодинамических процессов
- •12 Обобщающее значение политропных процесссов
- •13. Круговые процессы(циклы) Прямые и обратные
- •14 Цикл Карно и теорема Карно
10. Последовательность и обьем расчета термодинамических процессов
В тепловых двигателях при их работе протекают разнообразные термодинамические процессы. Целью изучения термодинамических процессов является установление закономерностей изменения параметров состояния ТДС и особенностей преобразования энергии в этих процессах.
Знание указанных закономерностей имеет важное значение для понимания процессов, протекающих в элементах ГТД и ДВС.
Анализ (или расчёт) термодинамических процессов производится обычно в следующей последовательности:
1. Определяют уравнение процесса: исходя из условий протекания процессов и используя уравнение состояния идеального газа, находят уравнения процесса в виде зависимостей
p = f (υ); T = f (υ); T = f (p).
2. Определяют закон изменения параметров на основании уравнения процесса и уравнения состояния, используя известные по условиям задачи значения параметров состояния в начале процесса (p1, υ1, T1), в конце процесса (p2, υ2, T2), а если требуется – то и в промежуточных состояниях.
3. Осуществляют графическое построение процесса в рабочей “p-υ” диаграмме и тепловой “T-s” диаграмме.
4. Определяют величины, входящие в первый закон термодинамики.
q = ∆U + L; T∙∆s = ∆U + pdυ
а) q
=
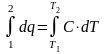 ;
;
б) ∆U
=
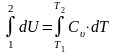 ;
;
в) L
=
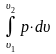 ;
;
г) ∆s1-2
=
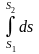 =
s2
– s1.
=
s2
– s1.
5. Определяют закон распределения энергии (α) для данного процесса по формуле α = ∆U/q.
Все величины, указанные в пунктах 2 и 4 могут, найдены как аналитически по уравнениям, так и графически с помощью рабочей “p-υ” диаграммы и тепловой “T-s” диаграммы. Поэтому любой расчёт процесса всегда сопровождается графическим построением процесса в этих координатах.
11. Определение, осуществление и исследование основных термодинамических процессов
Основными процессами в термодинамике являются:
изохорный, протекающий при постоянном объеме;
изобарный, протекающий при постоянном давлении;
изотермический, происходящий при постоянной температуре;
адиабатный, при котором теплообмен с окружающей средой отсутствует;
политропный, удовлетворяющий уравнению pvn= const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
уравнение процесса в p-v, иT-sкоординатах;
связь между параметрами состояния газа;
изменение внутренней энергии;
величину внешней работы;
количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
При изохорном процессе выполняется условие v = const.
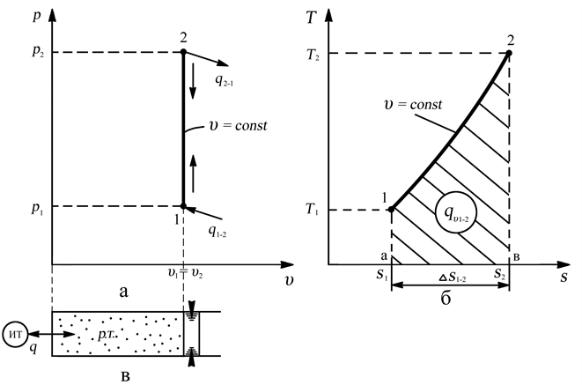 Из
уравнения состояния идеального газа
(pv = RT) следует:
Из
уравнения состояния идеального газа
(pv = RT) следует:
p/T = R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p2/p1 = T2/T1.
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
q= cv(T2 - T1).
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Δu = cv(T2 — T1).
Изменение энтропии в изохорном процессе определяется по формуле:
s2 – s1= Δs = cvln(p2/p1) = cvln(T2/T1).
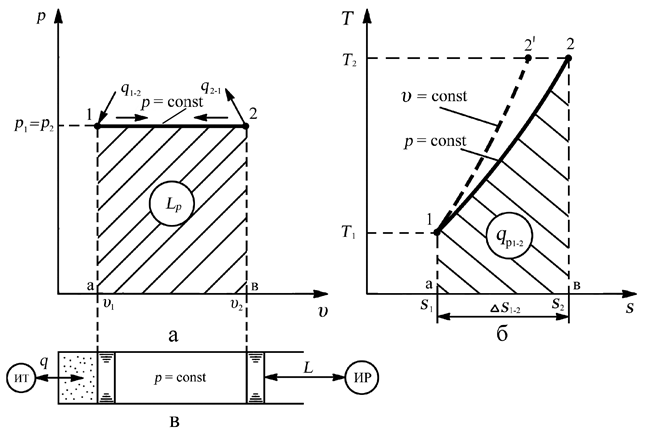
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
 v/T = R/p =
const
v/T = R/p =
const
или
v2/v1 = T2/T1,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l = p(v2 – v1).
Т. к. pv1 = RT1 и pv2 = RT2, то
l = R(T2 – T1).
Количество теплоты при cp = const определяется по формуле:
q = cp(T2 – T1).
Изменение энтропии будет равно:
s2 – s1= Δs = cpln(T2/T1).
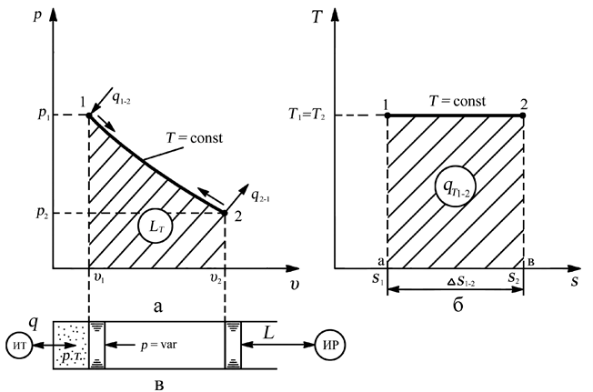
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
 pv = RT =
const
pv = RT =
const
или
p2/p1 = v1/v2,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l = RTln (v2 – v1) = RTln (p1 – p2).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q = l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s2 – s1= Δs = Rln(p1/p2) = Rln(v2/v1).
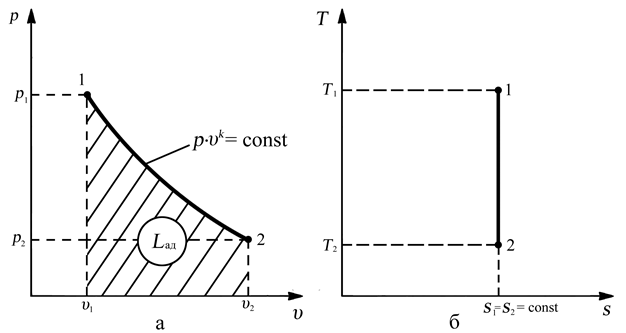
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
 du + pdv =
0
du + pdv =
0
или
Δu+ l = 0,
следовательно
Δu= -l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
dq = cадdT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
Известно, что
сp/cv = k
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
pvk = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
