
- •7. Внутренняя энергия термодинамической системы.Изменение внутренней энергии.Энтальпия
- •Энтальпия
- •8. Теплоемкость газа. Виды теплоемкости. Уравнение Майера
- •9. Сушность первого закона термодинамики. Аналитическое выражение первого закона термодинамики.
- •10. Последовательность и обьем расчета термодинамических процессов
- •11. Определение, осуществление и исследование основных термодинамических процессов
- •12 Обобщающее значение политропных процесссов
- •13. Круговые процессы(циклы) Прямые и обратные
- •14 Цикл Карно и теорема Карно
7. Внутренняя энергия термодинамической системы.Изменение внутренней энергии.Энтальпия
Газ (рабочее тело), как и всякая термодинамическая система, в любом состоянии обладает некоторым запасом энергии. Под энергией понимается форма существования материи и мера ее количественного движения.
E = m·c2 , (2.1)
где E – энергия; m – масса, c – скорость движения.
В термодинамике полная энергия макросистемы равна
E = Eкин + Eпот + U , (2.2)
где Екин – кинетическая энергия системы как целого;
Епот – потенциальная энергия системы во внешних силовых полях;
U – внутренняя энергия.
Величины Екин , Епот – определяются в соответствии с законами механики. А внутренняя энергия U – это энергия, заключённая в системе (рабочем теле) и включает в себя:
- кинетическую энергию поступательного, вращательного и колебательного движения молекул;
- потенциальную энергию взаимодействия молекул;
- энергию электронных оболочек атомов;
- внутриядерную энергию.
В идеальных газах нет сил взаимодействия между частицами вещества, поэтому внутренняя энергия таких газов определяется только внутренней кинетической энергией.
U = Uкин , Дж/кг . (2.4)
С увеличением температуры возрастает скорость хаотического движения частиц, что ведет к увеличению внутренней кинетической энергии, следовательно, при изменении температуры рабочего тела (газа) изменяется и его внутренняя энергия.
Таким образом, внутренняя энергия идеального газа зависит лишь от его температуры, а запас внутренней энергии зависит только от состояния системы. Следовательно, внутренняя энергия U есть функция состояния рабочего тела (газа) и полностью определяется его состоянием в данный момент времени.
Изменение
внутренней энергии
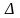 U
не зависит от характера термодинамического
процесса, а определяется только начальным
и конечным состоянием системы (рабочего
тела).
U
не зависит от характера термодинамического
процесса, а определяется только начальным
и конечным состоянием системы (рабочего
тела).
Энтальпия
Энтальпия (теплосодержание) представляет собой сумму внутренней энергии (U) и энергии давления (p·υ), обозначаются буквой (i)
i = U + p·υ , Дж/кг (2.31)
Учитывая, что p·υ = R·T , имеем
i = U + R·T , Дж/кг. (2.32)
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния ТДС, и может быть представлена в виде функции двух любых параметров состояния:
i1 = f 1(p, υ); i2 = f 2(p, T); i3 = f 3(υ, T);
i1-2 = i2 – i1 = Cp cp·(T2 – T1) , (2.36)
Сср – среднее значение теплоемкости в интервале температур
Отсюда следует, что изменение энтальпии при переходе газа из одного состояния “1” в другое “2” равно количеству подводимой (или отводимой) теплоты в интервале Т1…Т2 при постоянном давлении, причем независимо от фактического перехода при любом характере изменения давления.
Из вышеизложенного можно сделать важный вывод, что энтальпия характеризует способность рабочего тела (движущегося газа) совершать работу за счёт внутренней (тепловой) энергии и энергии давления.
