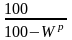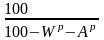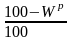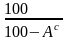- •Предисловие
- •Цель освоения учебной дисциплины
- •Место дисциплины в структуре ооп бакалавриата
- •Результаты образования, формируемые в процессе освоения учебной дисциплины
- •Раздел 1. Физико-химические основы теории горения топлива [гл.1 стр.6-18, 1]
- •Раздел 2. Способы сжигания топлива [ гл. 4 стр.48-56, 1]
- •Раздел 3. Горение газового и жидкого топлив [гл. 5 стр.56-67, 1]
- •Методические указания по выполнениЮ и оформлениЮ контрольнЫх заданий
- •Задание№ 1 Общие сведения
- •Примеры решения задач
- •Оглавление
- •Теория горения топлива
Методические указания по выполнениЮ и оформлениЮ контрольнЫх заданий
К выполнению контрольной работы следует приступать только после изучения соответствующего теоретического материала и определения необходимых исходных данных. Только сознательное («не механическое») проектирование приносит пользу и помогает закреплению знаний. Согласно учебному плану, необходимо выполнить одну контрольную работу, состоящую из трех заданий. При выполнении контрольной работы рекомендуется придерживаться следующих правил:
1. Контрольные задания, выполненные не по своему варианту, не рассматриваются. Номер варианта берется по цифре номера зачетной книжки студента. Например, зачетная книжка имеет шифр ЗПТ-16-08. Год поступления в КГЭУ при определении вашего варианта не учитывается, так как он у всех в группе одинаковый (в данном примере 08). Вариант определяется по цифре 16 (в середине шифра), где 1 – первая цифра номера, 6 – вторая цифра номера. На установочной лекции номер вашей зачетной книжки записывается в журнал учета преподавателя.
2. При выполнении контрольной работы необходимо:
- необходимо делать письменные пояснения, приводить соответствующие формулы, обязательно указывать размерности используемых в расчетах величин (невыполнение последнего требования равносильно ошибке);
- вычисления производить при помощи инженерного калькулятора или
компьютера с точностью до третьей значащей цифры;
- в ответах следует придерживаться общепринятых терминов и обозначений. Результаты решения должны быть представлены в единицах СИ;
- текст следует писать разборчиво, оставляя поле для замечаний рецензента, страницы нумеровать, выполненное задание подписать.
Задание№ 1 Общие сведения
В первом задании контрольной работы студент должен самостоятельно
решить 10 задач. В ходе выполнения задания студент должен: 1) определить номер своего варианта; 2) по номеру своего варианта выписать из таблиц, которые даны в приложении 1, индивидуальные исходные данные к каждой задаче; 3) решить все задачи в соответствии со своим вариантом и в соответствии с рекомендациями.
Все предлагаемые задачи в первом задании имеют пример решения. Исходные данные по вариантам и справочная информация находятся в таблицах П1.1 - П1.10 (прил. 1).
Примеры решения задач
При лабораторных исследованиях был получен элементный состав кузнецкого угля марки СС на горючую массу: Сг = 84,0%; Нг = 4,5%; Nг = 2,0%; Ог = 9%; Sг = 0,5%. Влажность и зольность на рабочую массу равны Wр = 12,0% и Ар = 11,4%. Определить элементный состав на рабочую массу топлива.
Исходные данные: Сг = 84,0%; Нг = 4,5%; Nг = 2,0%; Ог = 9%; Sг = 0,5%; Wр = 12,0%, Ар = 11,4%.
Решение. Пересчет элементарного состава одной массы топлива на другую производится при помощи коэффициентов, приведенных в табл.1.1.
Таблица 1.1 Коэффициенты для пересчета элементного состава топлива
Заданная масса топлива |
Искомая масса топлива |
||
рабочая |
сухая |
горючая |
|
рабочая |
1 |
|
|
сухая |
|
1 |
|
горючая |
|
|
1 |
Для пересчета с горючей массы на рабочую используем коэффициент пересчета
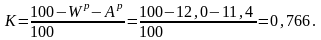
Тогда:
Ср = Сг ·К = 84,0 · 0,766 = 64,34 %;
Нр = Нг ·К = 4,5 · 0,766 = 3,45 %;
Nр = Nг ·К = 2,0 · 0,766 = 1,53 %;
Ор = Ог ·К = 9,0 · 0,766 = 6,90 %;
Sр = Sг ·К = 0,5 · 0,766 = 0,38 %.
Проверка: суммарный элементный состав топлива на рабочую массу: Ср + Нр + Nр + Ор + Sр + Wр + Ар = 64,34 + 3,45 + 1,53 + 6,90 + 0,38 + 12,0 + 11,40 = 100 %.
Для кузнецкого угля (элементный состав – см. пример 1.1) определить
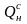 ,
,
 ,
,
 ,
если низшая теплота сгорания рабочей
массы равна
,
если низшая теплота сгорания рабочей
массы равна
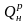 = 23 990 кДж/кг.
= 23 990 кДж/кг.
Исходные данные: Нр = 3,45%; Нг = 4,5%; Wр = 12,0%, Ар = 11,4%. = 23 990 кДж/кг.
Решение.
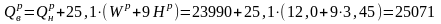 кДж/кг.
кДж/кг.
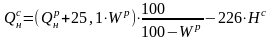 ,
кДж/кг.
,
кДж/кг.
Для определения Нс воспользуемся коэффициентом пересчета с рабочей массы на сухую:

Тогда Нс = Нр · К = 3,45 · 1,136 = 3,92 %.
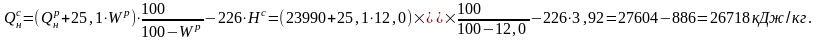

1.3. Определить объемный и массовый расход воздуха, необходимого для сжигания топлива, приведенного в примере 1.1.
Исходные данные: Ср = 64,34%; Нр = 3,45%; Ор =6,9%; Sр = 0,38%.
Решение. Определим теоретическое количество сухого воздуха, необходимого для полного сжигания топлива (α = 1).
Объемный расход воздуха, м3/кг:
Vо = 0,0889·(Ср + 0,375·Sр) + 0,265·Нр – 0,0333·Ор =
= 0,0889·(64,34 + 0,375·0,38) + 0,265·3,45 – 0,0333·6,9 = 6,417 м3/кг.
Массовый расход воздуха, кг/кг:
Lо = 0,115·(Ср + 0,375·Sр) + 0,342·Нр – 0,0431·Ор =
= 0,115·(64,34 + 0,375·0,38) + 0,342·3,45 – 0,0431·6,9 = 8,30 кг/кг.
1.4. Определить объемы продуктов сгорания для кузнецкого угля марки СС, приведенного в примере 1.1.
Исходные данные: Ср = 64,34%; Нр = 3,45%; Ор =6,9%; Sр = 0,38%; Nр = 1,53 %; Vо = 6,417 м3/кг.
Решение. При сжигании твердого топлива образуются следующие объемы продуктов сгорания, м3/кг:
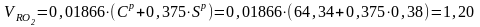 м3/кг.
м3/кг.
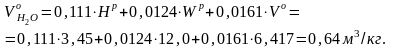
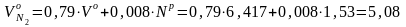 м3/кг.
м3/кг.
Суммарный объем продуктов сгорания:
 м3/кг.
м3/кг.
1.5. Как изменится объем и объемные доли трехатомных продуктов сгорания и водяных паров при сжигании бурого угля (состав задан) при избытке воздуха α = 1,20, если его влажность увеличилась до 40,0%?
Исходные данные: Ср = 26,0%; Нр = 2,1%; Nр = 0,4%; Ор = 8,2%; Sр = 2,7%; Wр = 32,0%, Ар = 28,6%.
Решение. Коэффициент пересчета на новую рабочую влажность
 .
.
В соотвестии с этим:
Ср2 = 26,0 · 0,882 = 22,94 %;
Нр2 = 2,1 · 0,882 = 1,85 %;
Nр2 = 0,4 · 0,882 = 0,35 %;
Ор2 = 8,2 · 0,882 = 7,24 %;
Sр2 = 2,7 · 0,882 = 2,38 %;
Ар2 = 28,6 · 0,882 = 25,24 %.
Проверка полученного элементного состава: 22,94 + 1,85 + 0,35 + 7,24 + 2,38 + 25,24 = 100 %.
Объемы воздуха и продуктов сгорания для исходного топлива:
Vо
= 2,68 м3/кг;
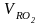 =
0,50 м3/кг;
=
0,50 м3/кг;
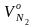 =
2,12
м3/кг;
=
2,12
м3/кг;
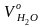 =
0,69
м3/кг;
=
0,69
м3/кг;
 = 3,31 м3/кг.
= 3,31 м3/кг.
При избытке воздуха α = 1,2 объем газов равен
Vг = + 1,0161·(α – 1)·Vо = 3,31 + 1,0161·(1,20 – 1,0)·2,68 = 3,85 м3/кг.
Объем водяных паров
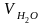 =
+
1,0161·(α –
1)·Vо
= 0,69 + 1,0161·(1,20 – 1,0)·2,68 = 0,70 м3/кг.
=
+
1,0161·(α –
1)·Vо
= 0,69 + 1,0161·(1,20 – 1,0)·2,68 = 0,70 м3/кг.
Доли трехатомных газов и водяных паров:
 =
0,50 / 3,85 = 0,130;
=
0,50 / 3,85 = 0,130;
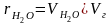 = 0,70 / 3,85 = 0,182.
= 0,70 / 3,85 = 0,182.
Определяем
объемы воздуха и продуктов сгорания
для угля влажностью
 = 40,0 %.
= 40,0 %.
Теоретическое количество сухого воздуха находим из выражения
 =
0,0889·(Ср
+ 0,375·Sр)
+ 0,265·Нр
– 0,0333·Ор
=
=
0,0889·(Ср
+ 0,375·Sр)
+ 0,265·Нр
– 0,0333·Ор
=
= 0,0889·(22,94 + 0,375·2,38) + 0,265·1,85 – 0,0333·7,24 = 2,37 м3/кг.
Теоретические объемы продуктов сгорания для нового состава топлива:
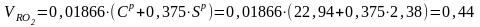 м3/кг.
м3/кг.
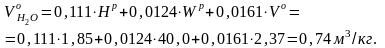
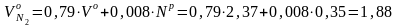 м3/кг.
м3/кг.
Суммарный объем продуктов сгорания:
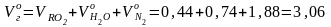 м3/кг.
м3/кг.
При избытке воздуха α = 1,2 находим объемы газов:
Vг = + 1,0161·(α – 1)·Vо = 3,06 + 1,0161·(1,2 – 1,0)·2,37 = 3,54 м3/кг.
и водяных паров
= + 1,0161·(α – 1)·Vо = 0,74 + 1,0161·(1,2 – 1,0)·2,37 = 0,75 м3/кг.
Определяем доли трехатомных газов и водяных паров:
= 0,44 / 3,54 = 0,124; = 0,75 / 3,54 = 0,212.
Таким образом, за счет снижения теплоты сгорания полный объем газов при возрастании влажности топлива несколько снизился, объем и доля трехатомных газов сократились, а водяных увеличились.
1.6 Определить энтальпии продуктов сгорания в точках смешения: в топке (при tтоп = 1700 °С, αтоп = 1,1) и перед промежуточным перегревателем (tпп = 850 °С, αпп = 1,16) при рециркуляции газов. Принять температуру в месте отбора газов на рециркуляцию tотб = 390 °С, αотб = 1,20; rрц = 0,15; топливо - мазут.
Исходные данные: tтоп = 1700 °С, αтоп = 1,1; tпп = 850 °С, αпп = 1,16; tотб = 390 °С, αотб = 1,20; rрц = 0,15. Топливо – мазут.
Решение. По таблице П1.3 приложения находим теоретические энтальпии газов и воздуха для заданного топлива при температурах газов 1700, 850 и 390 °С.
Энтальпия газов при избытке воздуха α > 1 составит:
Нг
=
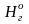 + (α – 1)·
+ (α – 1)·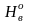 + Нэл
.
+ Нэл
.
при αтоп = 1,1 и tтоп = 1700 °С
Нг = 31522,5 + (1,1 – 1)·26814 = 34204 кДж/кг;
при αпп = 1,16 и tпп = 850 °С
Нг = 14595 + (1,16 – 1)·12609,5 = 16613 кДж/кг;
при αотб = 1,20 и tотб = 390 °С
Нг = 6303 + (1,20 – 1)·5512,2= 7405 кДж/кг.
Энтальпии газов в точках смешения на ходим по формуле:
Нг.рц = Нг + r · Нг.отб
- в топке
Нг.рц = 34204 + 0,15 · 7405 = 35315 кДж/кг;
- в газоходе перед промежуточным нагревателем
Нг.рц = 16613 + 0,15 · 7405 = 17724 кДж/кг.
1.7 Произвести расчет горения мазута заданного химического состава.
Исходные данные: горючая масса мазута имеет следующий состав: Сг = 87,4%; Нг = 11,2%; Ог = 0,5%; Nг = 0,4%; Sг = 0,5%. Золы Ар = 0,2 %, содержание влаги Wр = 3,0 %. Принять α = 1,2. Воздух поступает без подогрева. Влагосодержание воздуха d принять 0,016 кг/кг.
Решение.
Определим состав рабочего топлива:
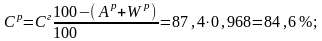
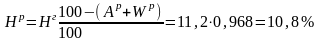 .
.
Остальные составляющие остаются без изменения в пределах точности анализа. Получаем состав рабочего топлива: Ср =84,6%; Нр = 10,8%; Ор = 0,5%; Nр = 0,4%; Sр = 0,5%; Ар = 0,2%; Wр = 3,0%.
Определим низшую теплоту сгорания мазута:
=
339·Ср
+ 1256·Нр
+ 109·(Sр
– Oр)
– 25·(9·Hр
+ Wр)
=

= 339·84,6 + 1256·10,8 + 109·(0,5 – 0,5) –
- 25·(9·10,8 + 3,0) = 39739 кДж/кг.
Теоретически необходимое для горения количество сухого воздуха:
Lтеор = 0,0889·Ср + 0,265·Нр – 0,0333·(Sр – Oр) =
0,0889 · 84,6 + 0,265 · 10,8 – 0,0333·(Sр – Oр) = 10,40 м3/кг.
Количество атмосферного воздуха при заданном влагосодержании:
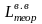 =
d
· Lтеор
= 1,016 · 10,40 = 10,57 м3/кг.
=
d
· Lтеор
= 1,016 · 10,40 = 10,57 м3/кг.
Действительное количество воздуха при α = 1,2:
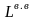 =
·
α =
10,57 · 1,2 = 12,68 м3/кг.
=
·
α =
10,57 · 1,2 = 12,68 м3/кг.
Количество и состав продуктов полного сгорания при α = 1,2:
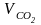 =
0,01855 · Ср
= 0,0185 · 84,6 = 1,569 м3/кг;
=
0,01855 · Ср
= 0,0185 · 84,6 = 1,569 м3/кг;
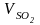 =
0,007 · Sр
= 0,007 · 0,5 = 0,0035 м3/кг;
=
0,007 · Sр
= 0,007 · 0,5 = 0,0035 м3/кг;
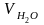 =
0,122·Нр
+ 0,0124·Wр
+ 0,0016·d·Lв.в
=
=
0,122·Нр
+ 0,0124·Wр
+ 0,0016·d·Lв.в
=
= 0,112 · 10,8 + 0,0124 · 3,0 + 0,0016 · 10 · 12,48 = 1,447 м3/кг;
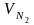 =
0,79 ·
+ 0,008 · Nр
= 0,79 · 12,48 + 0,008 · 0,4 = 9,862 м3/кг;
=
0,79 ·
+ 0,008 · Nр
= 0,79 · 12,48 + 0,008 · 0,4 = 9,862 м3/кг;
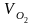 =
0,21·(α – 1)·
Lтеор
= 0,21 · (1,2 – 1)·10,40 = 0,437 м3/кг;
=
0,21·(α – 1)·
Lтеор
= 0,21 · (1,2 – 1)·10,40 = 0,437 м3/кг;
Общий объем продуктов горения при α = 1,2:
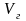 =
=
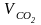 +
+
+
+
=
+
+
+
+
=
= 1,569 + 0,0035 + 1,447 + 9,862 +0,437 = 13,32 м3/кг.
Состав продуктов сгорания:
RО2
=
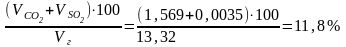 ;
;
N2
=
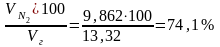 ;
;
Н2О
=
 ;
;
О2
=
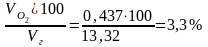 .
.
Теоретическая температура горения. Общая энтальпия продуктов сгорания без подогрева воздуха и топлива:
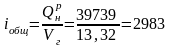 кДж/м3.
кДж/м3.
По приложению по диаграмме (i–t) при α = 1,2 находим теоретическую температуру горения: tтеор = 1818оС.
1.8 Произвести расчет горения жидкого топлива заданного химического состава.
Исходные данные: топливо – мазут, следующего химического состава: Ср = 85,9%; Нр = 9,9%; Nр = 0,3%; Ор = 0,5%; Sр = 0,4%; Wр = 2,8%, Ар = 0,2%. Коэффициент избытка воздуха α = 1,28; влажность воздуха φс.в = 13,9 г/м3; температура мазута t = 98°С; температура подогрева воздуха tв = 300°С.
Решение. Определим количество воздуха, необходимого для сжигания 1 кг мазута. Рассчитаем количество кислорода, окисляющего все горючие компоненты мазута:
= 0,01·(1,867·Ср + 5,6·Нр + 0,7·Sp – 0,7·Op) =
= 0,01·(1,867·85,9 + 5,6·9,9 + 0,7·0,4 – 0,7·0,5) = 2,157 м3/кг.
Теоретический расход сухого атмосферного воздуха будет равен:
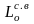 =
(1 + k)·
=
(1 + 3,76)·2,157 = 10,27 м3/кг.
=
(1 + k)·
=
(1 + 3,76)·2,157 = 10,27 м3/кг.
k = 79/21 = 3,76 – константа, представляющая соотношение азота и кислорода воздуха (принимается, что в качестве окислителя используется атмосферный воздух, состав которого принимают неизменным 21% кислорода и 79% азота).
Теоретический расход влажного воздуха:
 =
(1 + 0,00124·φс.в)·
=
=
(1 + 0,00124·φс.в)·
=
= (1+ 0,00124 · 13,9) ·10,27 = 10,44 м3/кг.
0,00124 – объем 1 грамма влаги.
Действительный расход влажного воздуха:
= α · = 1,28 · 10,44 = 13,36 м3/кг.
Определим количество и состав продуктов горения мазута при α = 1.
Количество диоксида углерода:
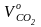 =
0,01 · 1,867·Ср
= 0,01 · 1,867 · 85,9 = 1,604 м3/кг.
=
0,01 · 1,867·Ср
= 0,01 · 1,867 · 85,9 = 1,604 м3/кг.
Количество диоксида серы:
 =
0,01 · 0,7·Sр
= 0,01 · 0,7 · 0,4 = 0,003 м3/кг.
=
0,01 · 0,7·Sр
= 0,01 · 0,7 · 0,4 = 0,003 м3/кг.
Количество водяных паров:
= 0,01·(11,2·Нр + 1,244·Wр) + 0,00124· φс.в · =
= 0,01·(11,2·9,9 + 1,244·2,8) + 0,00124·13,9·10,27 = 1,319 м3/кг.
Количество азота:
= 0,01·0,8·Nр + k· =
= 0,01·0,8·0,3 + 3,76·2,157 = 8,11 м3/кг.
Общий объем продуктов горения при α = 1
= + + + =
= 1,604 + 0,003 + 1,319 + 8,11 = 11,04 м3/кг.
Состав дымовых газов:
СО2
=
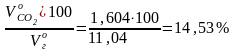 ;
;
SО2
=
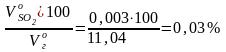 ;
;
N2
=
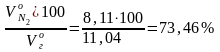 ;
;
Н2О
=
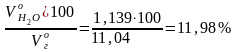 .
.
Определяем количество и состав продуктов горения при α = 1,28.
Количество диоксида углерода и диоксида серы останутся такими же, как и при α = 1.
Количество водяных паров увеличится за счет влаги избыточного воздуха:
= + 1,00124· φс.в ·(α – 1)· =
= 0,319 + 1,00124·13,9·(1,28 – 1,0)·10,27 = 1,368 м3/кг.
За счет избыточного воздуха увечится и количество азота:
= + k·(α – 1)· = 8,11 + 3,76·(1,28 – 1)·2,157 = 10,48 м3/кг.
В продуктах горения появится свободный кислород избыточного воздуха:
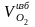 =
(α – 1)·
=
(1,28 – 1)·2,157 = 0,604 м3/кг.
=
(α – 1)·
=
(1,28 – 1)·2,157 = 0,604 м3/кг.
Общий объем продуктов горения при α = 1,28:
= + + + + =
= 1,604 + 0,003 + 1,368 + 10,48 +0,604 = 14,06 м3/кг.
Состав продуктов горения:
СО2
=
 ;
;
SО2
=
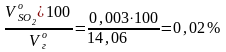 ;
;
N2
=
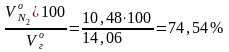 ;
;
Н2О
=
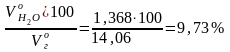 ;
;
О2
=
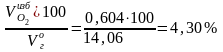 .
.
Рассчитаем низшую теплоту сгорания мазута:
= 339Ср + 1256Нр +109·(Ор – Sр) – 25·(9Нр + Wр) =
= 339 · 85,9 + 1256 · 9,9 + 109·(0,5 – 0,4) – 25·(9 · 9,9 + 2,8) = 37030,5 кДж/кг.
Рассчитаем температуру горения мазута. Сначала определим общее теплосодержание продуктов горения мазута без учета диссоциации, кДж/м3:
iобщ = iх + iв + iт .
Энтальпия единицы объема дымовых газов за счет химической энергии мазута:
iх
=
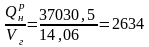 кДж/м3.
кДж/м3.
Подогретый до 300°С вентиляторный воздух вносит в один кубометр отходящих газов, кДж/м3:
iв
=
 .
.
Среднюю теплоемкость воздуха св находим по таблице П1.4 (приложение)
св = 1,315 кДж/(м3·К).
Тогда:
iв
=
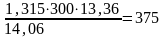 кДж/м3.
кДж/м3.
За счет подогрева мазута единица продуктов горения получает, кДж/м3:
iт
=
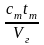 .
.
Средняя теплоемкость мазутов в интервале температур 20…100°С изменяется в пределах 1,88…2,28 кДж/(кг·К).
Тогда
iт
=
 кДж/м3.
кДж/м3.
iобщ = 2634 + 375 + 15 = 3024 кДж/м3.
Рассчитаем относительное содержание избыточного воздуха в единице продуктов горения мазута:
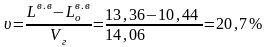 .
.
По it–диаграмме для мазутов (приложение, рис.1) находим теоретическую температуру горения: tтеор = 1875°С.
1.9 Произвести расчет горения природного топлива заданного химического состава.
Исходные данные: состав природного газа: СН4 = 93,0%; С2Н6 = 1,2%; С3Н8 = 0,7%; С4Н10 = 0,4%; С2Н12 = 0,2%; СО2 = 0,2%, N2 = 3,3%; Н2О = 1,0%. Коэффициент избытка воздуха α = 1,2; температура подогрева воздуха tв = 800°С. Принять: среднюю объемную теплоемкость воздуха, св = 0,3175 ккал/(м3·°С); фактический расход единицы объема газообразного топлива, Vт.ф. = 1 м3; среднюю объемную теплоемкость газообразного топлива,
ст = 0,3666 ккал/(м3·°С); температуру подогрева газообразного топлива, tт = 20°С.
Решение. Определим низшую теплоту сгорания газа:
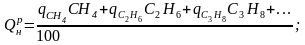
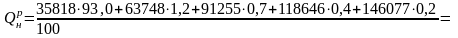
= 35482 кДж/кг
Теоретически необходимое количество сухого воздуха:
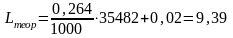 м3/м3.
м3/м3.
При влагосодержании атмосферного воздуха d = 0,01 кг/кг:
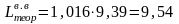 м3/м3.
м3/м3.
Действительное количество воздуха при коэффициенте расхода α = 1,2:
 м3/м3.
м3/м3.
Количество и состав продуктов сгорания при α = 1,2:
= 0,01·(СО2 + СН4 + 2С2Н6 + 3С3Н8 + 4С4Н10 + 5С2Н12) =
= 0,01·(0,2 + 93,0 + 2·1,2 + 3·0,7 + 4·0,4 + 5·0,2) = 1,003 м3/м3.
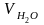 = 0,01·(2СН4
+ 3С2Н6
+ 4С3Н8
+ 5С4Н10
+ 6С2Н12
+ Н2О
+ 0,16·d·Lα)
=
= 0,01·(2СН4
+ 3С2Н6
+ 4С3Н8
+ 5С4Н10
+ 6С2Н12
+ Н2О
+ 0,16·d·Lα)
=
= 0,01 · (2 · 93,0 + 3 · 1,2 + 4 · 0,7 + 5 · 0,4 + 6 · 0,2 + 1,0 +
+ 0,16 · 10 · 11,27) = 2,146 м3/м3;
= 0,01·N2 + 0,79·Lα = 0,01 · 3,3 + 0,79 · 11,3 = 8,953 м3/м3;
= 0,21·(α – 1)· Lтеор = 0,21 (1,2 – 1) · 9,39 = 0,384 м3/м3;
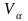 =
1,003 + 2,146 + 8,953 + 0,384
= 12,486 м3/м3
≈ 12,5 м3/м3.
=
1,003 + 2,146 + 8,953 + 0,384
= 12,486 м3/м3
≈ 12,5 м3/м3.
Процентный состав продуктов сгорания:
СО2
=
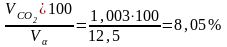 ;
;
N2
=
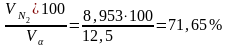 ;
;
Н2О
=
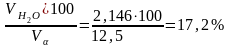 ;
;
О2
=
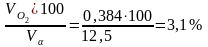 .
.
Определим теоретическую температуру горения. Общее теплосодержание продуктов горения при подогреве воздуха до 800 °С и α = 1,2:
iобщ
=
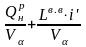 .
.
По
диаграмме (i–t)
находим теплосодержание при t
= 800 °С:
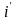 =
1109 кДж/м3,
тогда
=
1109 кДж/м3,
тогда
iобщ
=
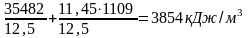 .
.
С
помощью уравнений для Tт
и Tк
при = 1,2 вычисляем теоретическую
температуру горения при a = = 1,2: tтеор
= 2190 0С.
Калориметрическая температура горения:
tк
= 2313 0С.
6.
Действительная температура печных
газов при h = 0,8:
![]() C.
C.
Найдем теоретическую температуру горения газообразного топлива при α = 1,2 без учета диссоциации двуокиси углерода и водяного пара:
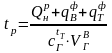 ,
,
где
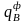 -
физическая теплота, вносимая подогретым
воздухом, ккал/м3;
-
физическая теплота, вносимая подогретым
воздухом, ккал/м3;
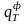 -
физическая теплота, вносимая подогретым
топливом, ккал/м3;
-
физическая теплота, вносимая подогретым
топливом, ккал/м3;
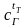 -
средняя теплоемкость продуктов горения,
ккал/(м3
· оС);
-
средняя теплоемкость продуктов горения,
ккал/(м3
· оС);
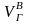 -
объем влажных продуктов горения топлива,
м3.
-
объем влажных продуктов горения топлива,
м3.
Физическую теплоту, вносимую предварительно подогретым воздухом определим по формуле:
= · св · tв = 11,45 · 0,3175 · 800 = 2908,3 ккал/м3.
Физическую теплоту, вносимую предварительно подогретым газообразным топливом определим по формуле:
=Vт.ф.· ст · tт = 1 · 0,3666 · 20 = 7,34 ккал/м3.
Приближенно примем, что теплоемкость продуктов горения природного газа, при температуре 1400-1800°С составляет Сг = 0,383 ккал/(м3·°С ).
Подставляя эти данные в формулу расчета теоретической температуры сгорания, получим:

Фактическая температура продуктов горения будет ниже теоретической из-за отдачи тепла в окружающее пространство в зоне горения. Определяется она в зависимости от пирометрического коэффициента ηпир, который определяется экспериментально и зависит от вида топлива, типа печи и режима ее работы и для методических (проходных) печей составляет 0,7…0,75. Найдем фактическую температуру по формуле:
tф = ηпир · tp = (0,7…0,75) · 2371,64 = 1660,1…1778,73 °С.
Таблица 1. Характеристика газообразного топлива
Газ |
Обозначение |
Теплота сгорания Qнс |
|
кДж/м3 |
ккал/м3 |
||
Водород |
Н, |
10820 |
2579 |
Окись углерода |
СО |
12640 |
3018 |
Сероводород |
Н2S |
23450 |
5585 |
Метан |
СН4 |
35850 |
8555 |
Этан |
С2Н6 |
63 850 |
15226 |
Пропан |
С3Н8 |
91300 |
21795 |
Бутан |
С4Н10 |
118700 |
22338 |
Пентан |
С5Н12 |
146200 |
34890 |
Этилен |
С2Н4 |
59200 |
14107 |
Пропилен |
С3Н6 |
85980 |
20541 |
Бутилен |
С4Н8 |
113 400 |
27111 |
Бензол |
С6Н6 |
140400 |
33528 |