- •Действие антикоагулянтов [править]
- •Применение антикоагулянтов [править]
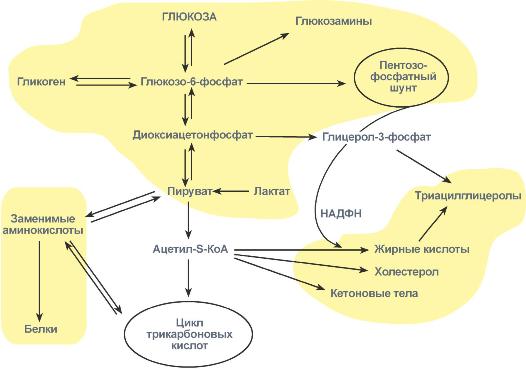
- •10.Особенности биологического окисления, его виды.
- •Гликолиз и глюконеогенез дополняют друг друга
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Желчные кислоты человека
- •№45. Изменения активности ферментов в плазме крови
- •Эндокринная сигнализация
- •Синаптическая передача
- •Паракринная сигнализация. Простогландины (пг)
- •№112. Нейрогормоны - биологически активные вещества, вырабатываемые нейросекреторными клетками. Нейрогормоны регулируют деятельность внутренних органов и центральной нервной системы.
- •Маточный цикл
- •Работа атф-синтазы
- •№156. Классификация ферментов
- •Амфотерность[править]
- •Растворимость[править]
- •Денатурация[править]
- •Гормоны аденогипофиза
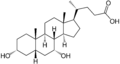
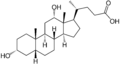
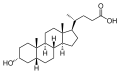
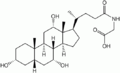
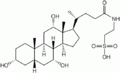
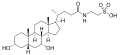
Желчные кислоты человека
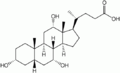
Холевая кислота
Хенодезоксихолевая кислота
Дезоксихолевая кислота
Литохолевая кислота
Гликохолевая кислота
Гликохенодезоксихолевая кислота
Таурохолевая кислота
Таурохенодезоксихолевая кислота
№44.
Эмульгирование жира |
В желчи, кроме желчных кислот, содержатся в небольшом количестве холестерин и фосфолипиды. После приема жирной пищи содержимое желчного пузыря поступает в просвет двенадцатиперстной кишки и желчные кислоты обволакивают капли жира, образуя тончайшую пленку, препятствующую слиянию мельчайших капелек жира в более крупные. При этом происходит резкое снижение поверхностного натяжения на границе двух фаз воды и жира, что приводит к образованию эмульсии с размерами частиц 300 1000 ммк и мицеллярного раствора с размерами частиц 3 30 ммк. Образование мицеллярных растворов облегчает действие панкреатической липазы, которая при воздействии на жиры расщепляет их на глицерин, легко всасывающийся кишечной стенкой, и жирные кислоты, не растворимые в воде. Небольшое количество свободных жирных кислот, образовавшихся в желудке под действием липазы, образует соли жирных кислот. Они также являются активным эмульгатором жиров. Наиболее эффективное эмульгирование жиров происходит при комбинированном действии на капельки жира трех веществ: солей желчных кислот, ненасыщенных жирных кислот и моноацилглицеролов. Желчные кислоты, соединяясь с жирными кислотами, образуют холеиновые кислоты, хорошо растворимые в воде и поэтому легко всасывающиеся кишечными ворсинками в верхних отделах тонкой кишки. Холеиновые кислоты в виде мицелл попадают из просвета подвздошной кишки внутрь клеток, сравнительно легко проходя мембраны клеток. В клетке связь желчных и жирных кислот распадается, желчные кислоты поступают через портальную вену в кровь и печень, а жирные кислоты накапливаются внутри цитоплазмы клето |
№45. Изменения активности ферментов в плазме крови
В этом разделе мы рассмотрим отдельные ферменты, имеющие важное значение для клиники. В последующих разделах будут обсуждаться данные об их применении в клинической практике. Аминотрансферазы Аминотрансферазы представляют собой ферменты, участвующие в переносе аминогрупп от а-амино- к а-оксокислотам. Кофактором в этой реакции является пиридоксальфосфат. Аминотрансферазы широко распространены в организме. Аспартатаминотрансфераза (ACT) ACT (сывороточная глутамат-оксалоацетаттрансаминазаг СГОТ) широко распространена с высокими концентрациями в сердце, печени, скелетных мышцах, почках, эритроцитах. Поражение любой из этих тканей может привести к повышению концентрации ACT в сыворотке крови. Причины повышения активности ACT
Артефакты: гемолиз in vitro или замедленное отделение плазмы от клеток.
Физиологические: у новорожденных активность ACT приблизительно в 1,5 раза выше, чем у здоровых взрослых.
Значительное повышение (в 10—100 раз, по сравнению с нормой): а) инфаркт миокарда; б) вирусный гепатит; в) токсический некроз печени; г) недостаточность кровообращения с шоком и гипоксией.
Умеренное повышение: а) цирроз (до 2 раз по сравнению с нормой); б) обтурационная желтуха (до 10 раз по сравнению с нормой); в) злокачественная инфильтрация печени; г) заболевание скелетной мускулатуры; д) после травмы или хирургической операции (особенно операции на сердце); е) тяжелая гемолитическая анемия; ж) инфекционный мононуклеоз (поражение печени
№46.
№47. Содержание и функции некоторых белков плазмы крови
Группа |
Белки |
Концентрация в сыворотке крови, г/л |
Функция |
Альбумины |
Транстиретин |
0,25 |
Транспорт тироксина и трийодтиронина |
|
Альбумин |
40 |
Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот |
α1-Глобулины |
α1 -Антитрипсин |
2,5 |
Ингибитор протеиназ |
|
ЛПВП |
0,35 |
Транспорт холестерола |
|
Протромбин |
0,1 |
Фактор II свёртывания крови |
|
Транскортин |
0,03 |
Транспорт кортизола, кортикостерона, прогестерона |
|
Кислый α1-гликопротеин |
1 |
Транспорт прогестерона |
|
Тироксинсвязывающий глобулин |
0,02 |
Транспорт тироксина и трийодтиронина |
α2-Глобулины |
Церулоплазмин |
0,35 |
Транспорт ионов меди, оксидоредуктаза |
|
Антитромбин III |
0,3 |
Ингибитор плазменных протеаз |
|
Гаптоглобин |
1 |
Связывание гемоглобина |
|
α2-Макроглобулин |
2,6 |
Ингибитор плазменных протеиназ, транспорт цинка |
|
Ретинолсвязыва-ющий белок |
0,04 |
Транспорт ретинола |
|
Витамин D связывающий белок |
0,4 |
Транспорт кальциферола |
β-Глобулины |
ЛПНП |
3,5 |
Транспорт холестерола |
|
Трансферрин |
3 |
Транспорт ионов железа |
|
Фибриноген |
3 |
Фактор I свёртывания крови |
|
Транскобаламин |
25×10-9 |
Транспорт витамина B12 |
|
Глобулин связывающий белок |
20×10-6 |
Транспорт тестостерона и эстрадиола |
|
С-реактивный белок |
<0,01 |
Активация комплемента |
γ-Глобулины |
IgG |
12 |
Поздние антитела |
|
IgA |
3,5 |
Антитела, защищающие слизистые оболочки |
|
IgM |
1,3 |
Ранние антитела |
|
IgD |
0,03 |
Рецепторы В-лимфоцитов |
|
IgE |
<0,01 |
Реагин |
685
Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меНbшую роль по сравнению с тироксинсвязывающим глобулином.
Ферменты плазмы крови в диагностике
Большинство ферментов представлено в клетках в значительно более высоких концентрациях, чем в плазме крови. Некоторые ферменты встречаются преимущественно в определенных типах клеток.
Нормальные уровни ферментов в плазме отражают соотношение между биосинтезом и высвобождением ферментов (при обычном обновлении клеток), а также их клиренсом из кровотока, повышение скорости их обновления, повреждение клеток или индуцирование ферментов обычно приводят к повышению содержания ферментов в плазме крови.
Эти изменения легко обнаружить, поскольку очень низкие концентрации ферментов легко измерить in vitro по их активности. Следовательно, ферменты можно использовать в качестве маркеров, чтобы обнаружить и локализовать повреждение или пролиферацию клеток.
В редких случаях активность ферментов в плазме крови может быть ниже, чем в норме, в связи либо с понижением биосинтеза, либо с наследственной недостаточностью или вариацией (примером чего служит недостаточность холинэстеразы)
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Смысл данного увеличения заключается в повышении резистентности клеток к окислению, в ограничении повреждения тканей, в подавлении скорости размножения бактерий.
К белкам острой фазы относят С-реактивный белок, сывороточный амилоид А, гаптоглобин, α2-макроглобулин, церулоплазмин, α1-гликопротеин, α1-антитрипсин, орозомукоид, компоненты комплемента С1-С4, С9. Трансферрин также относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативным белком острой фазы.
№48. Инсули́н (от лат. insula — остров) — гормон пептидной природы, образуется вбета-клетках островков Лангерганса Поджелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа.
№55. К чему может приводить самоускоряющийся процесс ПОЛ.
К разрущению клеток.
№56. Гипокалиемия — уменьшение [К+] в сыворотке крови ниже нормы (менее 3,4 ммоль/л). Существенно, что значительная часть К+ (около 155 ммоль/л) содержится в клетках. В связи с этим даже значительная потеря калия клетками может сочетаться с небольшими изменениями его содержания в сыворотке крови. Причины гипокалиемии • Недостаточное (менее 10 мэкв/сут) поступление калия в организм с пищей (например, при голодании или ограничении приёма продуктов, содержащих соединения калия, — овощей, молочных изделий). • Избыточное выведение калия из организма в результате: - Хронических профузных поносов. Кишечные секреты содержат большое количество калия. - Многократной рвоты. Содержание калия в желудочном соке невысокое. Однако развитие гиповолемии вызывает вторичный гиперальдостеро-низм и увеличение экскреции ионов К+ почками. - Повышенного выведения калия почками при: - Неправильном применении диуретиков. - Гиперальдостеронизме: - Первичном (у пациентов с опухолями или гипертрофией коры надпочечников). - Вторичном (например, при ишемии почек и повышении образования в них ренина, при сердечной недостаточности, при печёночной недостаточности). - Дефектах почечных канальцев — мембрано- и ферментопатиях (например, при синдроме Барттера), при почечном канальцевом ацидозе. - Повреждении почечной ткани нефротоксическими веществами, в том числе ЛС (например, некоторыми антибиотиками: пенициллинами, гентамицином или отдельными противогрибковыми средствами, в частности амфотерици-ном В).
Гиперкалиемия — увеличение [К+] в сыворотке крови выше нормального уровня (более 5,5 ммоль/л). Причины гиперкалиемии • Уменьшение экскреции почками в результате: - Почечной недостаточности. Почки способны выводить до 1000 мэкв/сут калия, т.е. значительно больше, чем его поступает в норме в организм. Повреждение почечной ткани может привести к гиперкалиемии при нормальном или даже несколько сниженном (по сравнению со статистической нормой) потреблении. - Гипоальдостеронизма (например, при болезни Аддисона — надпочечни-ковой недостаточности или снижении чувствительности эпителия канальцев к альдостерону у пациентов с нефропатиями, системной красной волчанкой [СКВ], амилоидозом, поражением интерстиция почек).
Перераспределение калия из клеток в кровь вследствие: - Повреждения и разрушения клеток (например, при гемолизе форменных элементов крови; гипоксии, ишемии и некрозе тканей; синдроме длительного раздавливания тканей, их ожоге или размозжении). - Гипоинсулинизма (в основном в связи с повышенным гликогенолизом и протеолизом, сопровождающимися высвобождением большого количества калия). - Внутриклеточного ацидоза. Это определяется избытком Н+ в клетках, что стимулирует выход К+ из них и одновременно
№58. Адренокортикотропный гормон (АКТГ), или кортикотропин, оказывает стимулирующее действие на кору надпочечников. В большей степени его влияние выражено на пучковую зону, что приводит к увеличению образования глюкокортикоидов, в меньшей - на клубочковую и сетчатую зоны, поэтому на продукцию минералокортикоидов и половых гормонов он не оказывает значительного воздействия. За счет повышения синтеза белка (цАМФ-зависимая активация) происходит гиперплазия коркового вещества надпочечников. АКТГ усиливает синтез холестерина и скорость образования прегненолона из холестерина. Вненадпочечниковые эффекты АКТГ заключаются в стимуляции липолиза (мобилизует жиры из жировых депо и способствует окислению жиров), увеличении секреции инсулина и соматотропина, накоплении гликогена в клетках мышечной ткани, гипогликемии, что связано с повышенной секрецией инсулина, усилении пигментации за счет действия на пигментные клетки меланофоры.
Продукция АКТГ подвержена суточной периодичности, что связано с ритмичностью выделения кортиколиберина. Максимальные концентрации АКТГ отмечаются утром в 6 - 8 часов, минимальные - с 18 до 23 часов. Образование АКТГ регулируется кортиколиберином гипоталамуса. Секреция АКТГ усиливается при стрессе, а также под влиянием факторов, вызывающих стрессогенные состояния: холод, боль, физические нагрузки, эмоции. Гипогликемия способствует увеличению продукции АКТГ. Торможение продукции АКТГ происходит под влиянием самих глюкокортикоидов по механизму обратной связи
№59. Освобождающаяся в процессе биологического окисления энергия частично выделяется в виде тепла, основная же ее часть идет на образование молекул сложных фосфорорганических соединений (главным образом аденозинтрифосфата — АТФ), которые являются источниками энергии, необходимой для жизнедеятельности организма
Трансформация энергии окисления осуществляется ферментами, расположенными во внутренней мембране митохондрий и работающими как генераторы, которые используют в качестве носителя электрического заряда ион водорода (Н+, протон). По определению, окислительными (точнее, окислительно-восстановительными) реакциями называют такие, в которых происходит перенос электронов от молекулы-донора (восстановителя) к молекуле-акцептору (окислителю). Эти реакции чрезвычайно распространены в живых системах и катализируются ферментами, получившими название оксидоредуктаз. Совокупность оксидоредуктаз, катализирующих процесс внутриклеточного дыхания, обычно называют дыхательной цепью. Для ответа на вопрос о том, как возникает электричество в мембране митохондрий, предстоит рассмотреть, как работает дыхательная цепь.
№62. С 142
№64. Основным предшественником синтеза этих веществ является арахидоновая кислота, депонированная в клетках в форме эфиров холестерина
№65. А. Катаболизм гема
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного
645
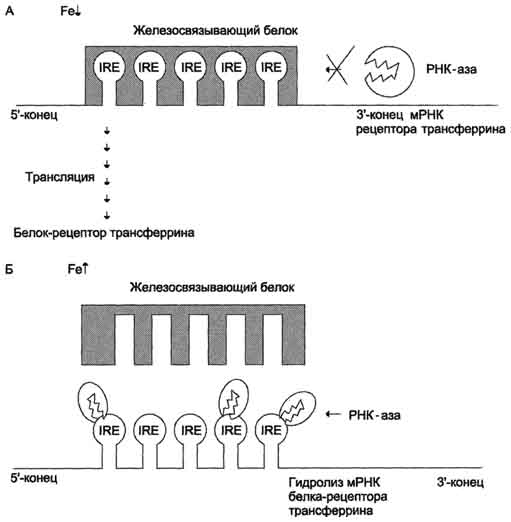
Рис. 13-10. Регуляция синтеза рецептора трансферрина. А - при низком содержании железа в клетке железочувствительный белок обладает высоким сродством к IRE мРНК, кодирующей белок-рецептор трансферрина. Присоединение железосвязывающего белка к IRE мРНК предотвращает её разрушение РНК-азой и синтез белка-рецептора трансферрина продолжается; Б - При высоком содержании железа в клетке сродство железосвязывающего белка к IRE снижается, и мРНК становится доступной для действия РНК-азы, которая её гидролизует. Разрушение мРНК ведёт к снижению синтеза белка-рецептора трансферрина.
комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца (рис. 13-11). В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему.
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой.Билирубин образуется не только при распаде гемоглобина, не также при катаболизме других гемсодержащю белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека - примерно 250-350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
646
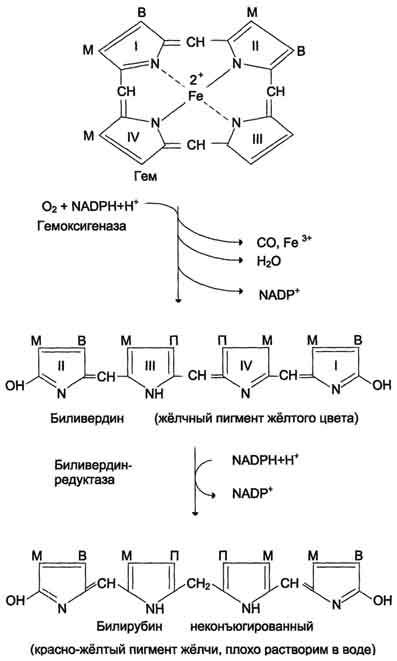
Рис. 13-11. Распад гема. М - (-СН3) - метильная группа; В - (-СН=СН2) - винильная группа; П - (-CH2-CH2-COOH) - остаток пропионовои кислоты. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца. Образованный биливердин под действием биливердинредуктазы превращается в билирубин.
Б. Метаболизм билирубина
Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Каждая молекула альбумина связывает (или даже 3) молекулы билирубина, одна из которых связана с белком более прочно (более высокое сродство), чем другие. При сдвиге рН крови в кислую сторону (повышение концентрации кетоновых тел, лактата) изменяются заряд, конформация альбумина, снижается сродство к билирубину. Поэтому билирубин, связанный с альбумином непрочно, может вытесняться
647
из центров связывания и образовывать комплексы с коллагеном межклеточного матрикса и липидами мембран. Ряд лекарственных соединений конкурирует с билирубином за высокоаффинный, имеющий высокое сродство центр альбумина.
Поглощение билирубина паренхиматозными клетками печени
Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z. Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке.
Лигандин и протеин Z обнаружены также в клетках почек и кишечника, поэтому при недостаточности функции печени они способны компенсировать ослабление процессов детоксикации в этом органе.
Конъюгация билирубина в гладком ЭР
В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты.Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо
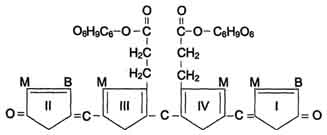
Рис. 13-12. Структура билирубиндиглюкуронида (конъюгированный, "прямой" билирубин). Глюкуроновая кислота присоединяется эфирной связью к двум остаткам пропионовой кислоты с образованием ацилглюкуронида.
растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин) (рис. 13-12).
Донором глюкуроновой кислоты служит УДФ-глюкуронат. Специфические ферменты, УДФ-глюкуронилтрансферазы (уридиндифосфоглюкуронилтрансферазы) катализируют образование моно- и диглюкуронидов билирубина (рис. 13-13). Индукторами синтеза УДФ-глюкуронилтрансфераз служат некоторые лекарственные препараты, например, фенобарбитал (см. раздел 12).
Секреция билирубина в жёлчь
Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т.е. против градиента концентрации. Активный транспорт является, вероятно, ско-рость-лимитирующей стадией всего процесса метаболизма билирубина в печени. В норме диглюкуронид билирубина - главная форма экскреции билирубина в жёлчь, однако не исключается
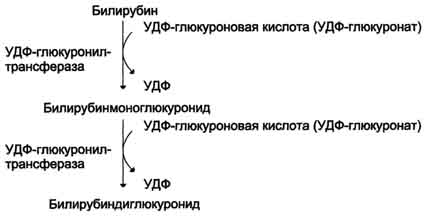
Рис. 13-13. Образование билирубиндиглюкуронида.
648
присутствие небольшого количества моноглюкуронида. Транспорт конъюгирован-ного билирубина из печени в жёлчь активируется теми же лекарствами, которые способны индуцировать конъюгацию билирубина. Таким образом, можно сказать, что скорость конъюгации билирубина и активный транспорт билирубинглюкуронида из гепатоцитов в жёлчь строго взаимосвязаны (рис. 13-14).
В. Катаболизм билирубин-диглюкуронида
В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ерментами β-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тет-рапиррольных соединений - уробилиногенов (рис. 13-15).
В подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается, попадает с кровью воротной вены в печеНb. Основная часть уробилиногена из печени в составе жёлчи выводится в кишечник и выделяется с фекалиями из организма, часть уробилиногена
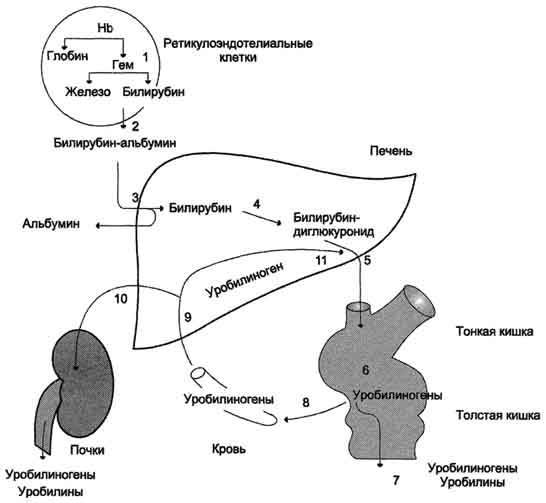
http://www.biochemistry.ru/biohimija_severina/B5873Pa..
№66. КАТАБОЛИЗМ ПУРИНОВЫХ НУКЛЕОТИДОВ
У человека основной продукт катаболизма пуриновых нуклеотидов - мочевая кислота. Её образование идёт путём гидролитического отщепления фосфатного остатка от нуклеотидов с помощью нуклеотидаз или фосфатаз, фосфоролиза N-гликозидной связи нуклеозидов пуриннуклеозидфосфорилазой, последующего дезами-нирования и окисления азотистых оснований (рис. 10-9).
От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием ИМФ или инозина. ИМФ и ГМФ превращаются в соответствующие нуклеозиды: инозин и гуанозин под действием 5´-нуклеотидазы. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с образованием рибозо-1-фосфата и азотистых оснований: гуанина и гипоксантина. Гуанин дезаминируется и превращается в ксантин, а гипоксантин окисляется в ксантин с помощью ксантиноксидазы, которая катализирует и дальнейшее окисление ксантина в мочевую кислоту.
Ксантиноксидаза - аэробная оксидоредуктаза, простетическая группа которой включает ион молибдена, железа (Fe3+) и FAD. Подобно другим оксидазам, она окисляет пурины молекулярным кислородом с образованием пероксида водорода. В значительных количествах фермент обнаруживается только в печени и кишечнике.
Мочевая кислота удаляется из организма главным образом с мочой и немного через кишечник с фекалиями. У всех млекопитающих, кроме приматов и человека, имеется фермент уриказа, расщепляющий мочевую кислоту с образованием аллантоина, хорошо растворимого в воде (рис. 10-10).
Амфибии, птицы и рептилии, подобно человеку, лишены уриказы и экскретируют мочевую
529
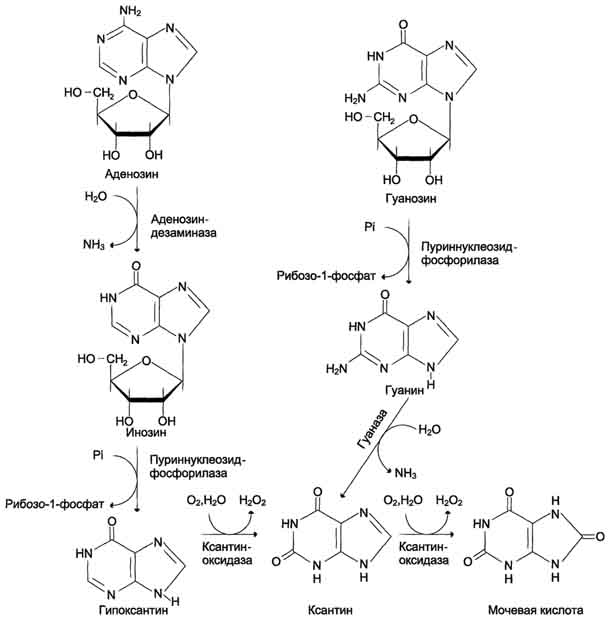
Рис. 10-9. Катаболизм пуриновых нуклеотидов до мочевой кислоты.
кислоту и гуанин в качестве конечных продуктов обмена.
Мочевая кислота является слабой кислотой. Содержание недиссоциированной формы и солей (уратов) зависит от рН раствора. При физиологических значениях рН у мочевой кислоты может диссоциировать только один протон из трёх (рК = 5,8), поэтому в биологических жидкостях присутствует как недиссоциированная кислота в комплексе с белками, так и её натриевая соль.
В сыворотке крови в норме содержание мочевой кислоты составляет 0,15-0,47 ммоль/л или 3-7 мг/дл. Ежесуточно из организма выводится от 0,4 до 0,6 г мочевой кислоты и уратов.
Вторичная гиперурикемия может быть вызвана увеличением поступления пурина с пищей, что сопровождается увеличением экскреции мочевой кислоты с мочой. Вторичная гиперурикемия связана с различными состояниями: почечная недостаточность, миелопролиферативные заболевания, гемолитические заболевания, псориаз, истинная полицитемия, избыточное потребление алкоголя, отравление свинцом, диета с повышенным содержанием пурина, голодание, истощение и химиотерапия
Вторичная гиперурикемия:
Увеличение поступления пуринов с пищей.
Почечная недостаточность.
Миелопролиферативные заболевания.
Гемолитические анемии.
Псориаз.
Истинная полицитемия.
Избыточное потребление алкоголя.
Отравление свинцом.
Голодание, истощение.
Химиотерапия.
67. Кетоновые тела — это ацетоуксусная, (β-оксимасляная кислоты и ацетон. Количество их в условиях нормы невелико. При углеводном голодании их содержание может существенно повышаться, вплоть до появления запаха ацетона в выдыхаемом воздухе. Это состояние носит название кетоз. Причины кетоза — любые состояния, затрудняющие использование углеводов: ограничение в питании, нарушения всасывания углеводов, сахарный диабет, интенсивная мышечная нагрузка
При достаточном поступлении углеводов с пищей и нормальном поступлении глюкозы в клетки, обеспечиваемом инсулином, увеличивается содержание метаболитов ЦТК. Два из них (цитрат и изоцитрат) стимулируют ацетил-КоА-карбоксилазу, которая катализирует образование малонил-КоА — первого продукта на пути синтеза жирных кислот. Следовательно, ускорится и синтез последних. Накопление ацетил-КоА тормозит декарбоксилирование пирувата. В связи с этим повышается использование глюкозо-6-фосфата по пентозофосфатному пути, а это ведет к накоплению НАДФН2 необходимого для синтеза липидов.
В норме пополнение и расходование липидов изменяются таким образом, что периодически один из процессов преобладает над другим и это обеспечивает гомеостаз липидов.
В итоге можно сделать вывод о том, что избыточное поступление углеводов с пищей, не компенсируемое энерготратами, может сопровождаться чрезмерным накоплением липидов. Недостаточное поступление углеводов с пищей или не компенсируемые углеводами энерготраты, а также нарушения потребления глюкозы клетками (диабет сахарный) сопровождаются мобилизцией липидов и появлением кетоза.
№69. С 282
№70. http://www.nmiff.ru/paradeigma/neiro.htm