
- •Действие антикоагулянтов [править]
- •Применение антикоагулянтов [править]
- •10.Особенности биологического окисления, его виды.
- •Гликолиз и глюконеогенез дополняют друг друга
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Желчные кислоты человека
- •№45. Изменения активности ферментов в плазме крови
- •Эндокринная сигнализация
- •Синаптическая передача
- •Паракринная сигнализация. Простогландины (пг)
- •№112. Нейрогормоны - биологически активные вещества, вырабатываемые нейросекреторными клетками. Нейрогормоны регулируют деятельность внутренних органов и центральной нервной системы.
- •Маточный цикл
- •Работа атф-синтазы
- •№156. Классификация ферментов
- •Амфотерность[править]
- •Растворимость[править]
- •Денатурация[править]
- •Гормоны аденогипофиза
Амфотерность[править]
Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. В белках присутствуют несколько типов химических группировок, способных к ионизации в водном растворе: карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь, ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остатокгистидина). Каждый белок характеризуется изоэлектрической точкой (pI) — кислотностью среды (pH), при которой суммарный электрический заряд молекул данного белка равен нулю и, соответственно, они не перемещаются в электрическом поле (например, при электрофорезе). В изоэлектрической точке гидратация и растворимость белка минимальны. Величина pI зависит от соотношения кислых и основных аминокислотных остатков в белке: у белков, содержащих много кислых аминокислотных остатков, изоэлектрические точки лежат в кислой области (такие белки называют кислыми), а у белков, содержащих больше основных остатков, — в щелочной (основные белки).
Растворимость[править]
Белки различаются по степени растворимости в воде. Водорастворимые белки называются альбуминами, к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка ипаутины[16]. Растворимость белка определяется не только его структурой, но внешними факторами, такими как природа растворителя, ионная сила и pH раствора[14].
Белки также делятся на гидрофильные и гидрофобные (водооталкивающие). К гидрофильным относится большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относится большинство белков, входящих в состав биологических мембран, — интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны[17] (у этих белков, как правило, есть и гидрофильные участки).
Денатурация[править]
Денатурацией белка называют любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры (см. раздел «Структура белка»). Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме[7]. Резкое изменение этих условий приводит к денатурации белка. В зависимости от природы денатурирующего агента выделяют механическую (сильное перемешивание или встряхивание), физическую (нагревание, охлаждение, облучение, обработка ультразвуком) и химическую (кислоты и щёлочи, поверхностно-активные вещества, мочевина) денатурацию[14].
Электрофорез (от др.-греч. ἤλεκτρον — янтарь[1], и φορέω — «переношу») — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым иФ. Ф. Рейссом в 1809 году.
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры. Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока) ианафорез — когда заряд поверхности положительный.
Электрофорез применяют в физиотерапии, для окраски автомобилей, в химической промышленности, для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
194 фолиевая кислота
Фо́лиевая кислота́ (витамин B9; лат. acidum folicum от лат. folium — лист) — водорастворимый витамин, необходимый для роста и развития кровеносной и иммунной систем. Наряду с фолиевой кислотой к витаминам относятся и её производные, в том числе ди-, три-, полиглутаматы и другие. Все такие производные вместе с фолиевой кислотой объединяются под названиемфолацин.
Недостаток фолиевой кислоты может вызвать мегалобластную анемию у взрослых, а при беременности повышает риск развитиядефектов нервной трубки.
Животные и человек не синтезируют фолиевую кислоту, а получают её вместе с пищей, либо благодаря синтезу микрофлоройкишечника. Фолиевая кислота в значимых количествах содержится в зелёных овощах с листьями, в некоторых цитрусовых, вбобовых, в хлебе из муки грубого помола, дрожжах, печени, входит в состав мёда. Во многих странах законодательство обязывает производителей мучных продуктов обогащать зерна фолиевой кислотой. В процессе приготовления пищи часть фолатов разрушается.
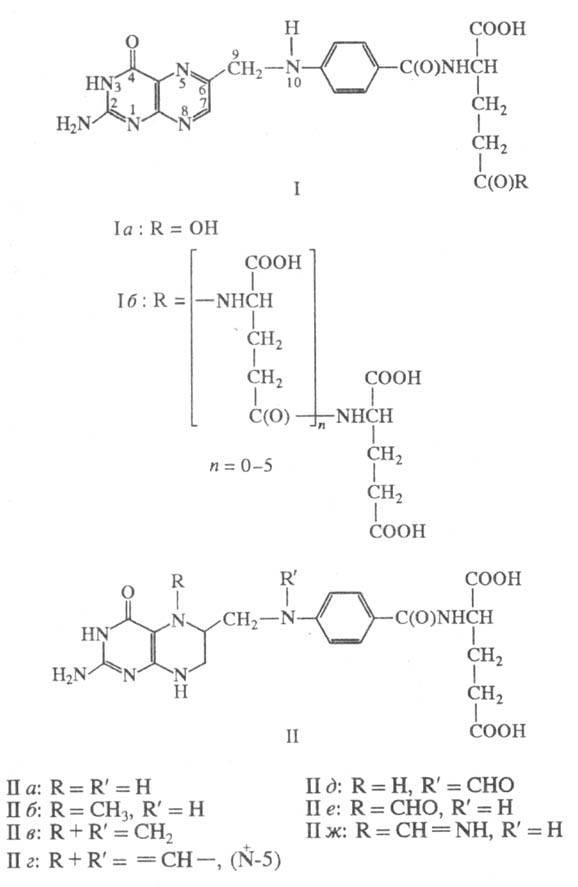
Биологически активные формы фолиевой кислоты -5 6,7,8-тетрагидрофолиевая кислота (ТГФК; II а) и ее производные (коферментные формы фолацина)•
201.ЧЕМ ОБУСЛОВЛЕНО ВРОЖДЕННЫЕ ПОРОКИ МЕТАБОЛИЗМА .ПРИМЕР
Формирование пороков происходит преимущественно в период эмбрионального морфогенеза (3-10-я неделя беременности) в результате нарушения процессов размножения, миграции, дифференциации и гибели клеток. Эти процессы происходят на внутриклеточном, экстраклеточном, тканевом, межтканевом, органном и межорганном уровнях. Нарушением размножения клеток объясняют гипоплазию и аплазию органов. Нарушение их миграции лежит в основе гетеротопий. Задержка дифференциации клеток обусловливает незрелость или персистирование эмбриональных структур, а ее полная остановка - аплазию органа или его части. Нарушение физиологической гибели клеток, как и нарушение механизмов адгезии ("склеивание" и срастание эмбриональных структур), лежат в основе многих дизрафий (например, спинномозговых грыж).
Экспериментальной эмбриологией доказано, что в формировании пороков развития большое значение имеет т. н. тератогенетический терминационный период, то есть тот отрезок времени, в течение которого тератогенный агент может вызвать врождённый порок развития. Этот период для разных органов различен. Пользуясь данными эмбриологии, можно судить о сроках возникновения того или иного порока развития и составлять тератологические календари для пороков развития разных органов.
В основе формирования пороков развития могут лежать также остановка развития в критический период, нарушение процесса формирования, или дисонтогенез, и деструкция ткани. При этом может происходить недоразвитие органов либо их частей (гипогенезия) или избыточное их развитие (гипергенезия), отсутствие органов или части тела (агенезия), неправильное положение или перемещение органов, неправильное формирование той или иной ткани (дисплазия).
«Пороки развития» это широкая категория, которая включает различные условия: незначительные физические аномалии (например родимые пятна), серьёзные нарушения отдельных систем (например врождённые пороки сердца или пороки конечностей), и комбинации аномалий затрагивающих несколько частей тела. Врождённые дефекты метаболизма также считаются врождёнными пороками.
Существуют 3 основных типа врождённых пороков:
Врождённые физические аномалии
Врожденные ошибки метаболизма
Другие генетические дефекты
206.
Р450 играют важную роль в окислении многочисленных соединений, как эндогенных (стероиды, желчные кислоты, жирные кислоты, проста- гландины, лейкотриены, биогенные амины), так и экзогенных (лекарства, яды, продукты промышленного загрязнения, пестициды, канцерогены, мутагены и т.п.), последние называют ксенобиотиками.
По типу катализируемых реакций Р450 можно отнести к монооксигеназам внешнего типа. В присутствии доноров электронов (NAD(P)H) Р450 способен активировать молекулярный кислород, один атом которого затем внедряется в молекулу окисляемого субстрата, а другой восстанавливается до воды'
R + AH + O L ROH + A + H O где R - субстрат, ROH - продукт, AH - донор электронов.
207.
Превращение фибриногена в фибрин происходит в несколько стадий. Сначала фермент тромбин отщепляет от молекулы фибриногена четыре небольших пептида (фибринопептиды), в результате чего образуется активная форма фибриногена — фибрин-мономер. Последний способен спонтанно полимеризоваться с построением волокон фибрина, формирующих впоследствии непрерывную сеть — основу кровяного сгустка.
Рассмотрим подробнее эти превращения. На первой стадии тромбин из центрального домена (Е) молекулы фибриногена вычленяет фибринопептиды; от полипептидных цепей Аа отщепляется 2 фибринопептида А, содержащих по 16-ть аминокислотных остатков каждый, от полипептидных цепей Bp отщепляется два фибринопептида В, которые имеют по 14-ть аминокислотных остатков. При этом расщепляются связи Apr—Гли, образуется мономерный фибрин, в N-концевом положении которого находятся остатки глицина.
Фактор XIIIа катализирует сшивание мономеров фибрина через образование связей между аминокислотами в положениях гамма глутамил-эпсилон лизин ( Folk J.E.,1977 ; Aeschlimann D.,1994 ; Adany R.,2001 ). Данная реакция требует присутствия ионов кальция . Сшивание приводит к димеризации гамма цепей фибрина (гамма димеризация) с последующей полимеризацией альфа цепей фибрина (альфа полимеризация). Гамма димеризация и альфа полимеразация приводят к образованию фибрина , обладающего значительной механической силой и резистентностью к протеолитической деградации плазмином ( Schwartz M.L.,1971 ;Murthy S.N.P.,1991 ). Фактор XIIIа катализирует также сшивание альфа цепей фибрина и альфа-2 ингибитора ( Sakata Y.,1980 ), фибронектина ( Mosher D.F.,1975 ), фибронектина и фибрина ( Mosher D.F.,1975 ), a также сшивание цепей между коллагеном и фибронектином (Mosher D.F.,1979 ). Другими субстратами для фактора XIIIа являются коагуляционный фактор V ( F V ), альфа-макроглобулин , пластиночный миозин , актин , фибронектин. Фактор XIII кроме своей основной функции в свертывании крови, играет роль и в стабилизации клеточной поверхности мембран. Фактор XIII - прототип класса кальций-зависимых трансглютаминаз с тиоловым активным центром, которые широко распространены в тканях животных и ассоциированы с пролиферацией клеток, эмбриональным развитием и ростом
94
Регуляция обмена кальция осуществляется в основном за счет действия паратирина и кальцитонина.Паратгормон, или паратирин, паратиреоидный гормон, синтезируется в околощитовидных железах. Он обеспечивает увеличение уровня кальция в крови. Органами-мишенями для этого гормона являются кости и почки. В костной ткани паратирин усиливает функцию остеокластов, что способствует деминерализации кости и повышению уровня кальция и фосфора в плазме крови. В канальцевом аппарате почек паратирин стимулирует реабсорбцию кальция и тормозит реабсорбцию фосфатов, что приводит к гиперкальциемии и фосфатурии. Развитие фосфатурии может иметь определенное значение в реализации гиперкальциемического эффекта гормона. Это связано с тем, что кальций образует с фосфатами нерастворимые соединения; следовательно, усиленное выведение фосфатов с мочой способствует повышению уровня свободного кальция в плазме крови. Паратирин усиливает синтез кальцитриола, который является активным метаболитом витамина D3. Последний вначале образуется в неактивном состоянии в коже под влиянием ультрафиолетового излучения, а затем под влиянием паратирина происходит его активация в печени и почках. Кальцитриол усиливает образование кальцийсвязывающего белка в стенке кишечника, что способствует обратному всасыванию кальция и развитию гиперкальциемии. Таким образом, увеличение реабсорбции кальция в кишечнике при гиперпродукции паратирина в основном обусловлено его стимулирующим действием на процессы активации витамина D3. Прямое влияние самого паратирина на кишечную стенку весьма незначительно.
96.
Витаминами B12 называют группу кобальтсодержащих биологически активных веществ, называемых кобаламинами. К ним относят собственноцианокобаламин — продукт, получаемый при химической очистке витамина цианидами, гидроксикобаламин и две коферментные формы витамина B12: метилкобаламин и 5-дезоксиаденозилкобаламин.
Ни животные, ни растения не способны синтезировать витамин В12. Это единственный витамин, синтезируемый почти исключительно микроорганизмами: бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В12 печень и почки. Этот витамин вырабатывается микроорганизмами в пищеварительном тракте любого животного, включая человека, как продукт деятельности микрофлоры. В пищевой промышленности многих стран витамин добавляют в такие продукты, как сухие завтраки, шоколадные батончики, энергетические напитки.
Витамин В12 обладает липотропным действием, стимулируя образование метионина и холина. В связи с этим он предупреждает развитие жировой инфильтрации печени у животных, находящихся на малобелковой диете.
97.
Витамин Е (токоферол) является важнейшим антиоксидантом, обладает мембраностабилизирующей функцией. Токоферол включается преимущественно в ту часть липидного слоя, где сосредоточены фосфолипиды с высоким содержанием двойных связей. Защищая мембраны, токоферол способствует сохранению активности мембраносвязанных ферментов. Гиповитаминоз витамина Е сопровождается увеличением концентрации свободных радикалов в печени, сердце, мышцах и других органах. При дефиците токоферола может наблюдаться ускоренное развитие атеросклероза, артериальная гипертензия, нарушение гуморального иммунитета, развитие кардиомиопатии, появление очагов некроза в печени, нарушение структуры нейронов. Витамин Е, наряду с другими витаминами-антиоксидантами, играет роль природного иммунорегулятора: стимулирует продукцию антител за счет подавления функции Т-супрессоров, нормализует состояние клеточного и гуморального иммунитета, повышает фагоцитарную активность нейтрофилов.
98.
Витамин B – группа витаминов, в природных продуктах всегда существующих вместе. Витамины группы B участвуют в тканевом дыхании и выработке энергии, играют важную роль в поддержании эмоционального здоровья. Они относятся к водорастворимым витаминам и не накапливаются в организме, поэтому их следует употреблять ежедневно. Всего в группе 13 витаминов.
В1 тиминдифосфат
В2 ФМН и ФАД
В3 коА
В5 никатинамидадениндинуклеотид над и надф
В6 фосфопиродоксаль
В9 формилпроизводными и метилпроизводными кислотами
В12 метил-кобаламин дезоксиаденозилкобаламин
99.
