
- •1. Температура
- •§1. Температура және термодинамикалық тепе-теңдік
- •§2 Термоскоп және температуралық нүктелер
- •§3 Температура шкалалары
- •2. Идеал газдың молекула-кинетикалық теориясы
- •§4.Идеал газ
- •§5. Газ қысымы. Молекула-кинетикалық теорияның негізгі теңдеуі
- •§6. Идеал газ күйінің теңдеуі
- •§7. Идеал газ заңдары
- •§8. Орташа квадраттық жылдамдық
- •Бақылау сұрақтары:
- •§9. Барометрлік формула
- •Бақылау сұрақтары:
- •§10. Больцман таралуы
- •§11. Ықтималдықтар теориясынан қысқаша түсінік
- •§12. Кездейсоқ шаманың орташа мәні. Ықтималдықтардың таралу функциясы
- •§13. Жүйенің макроскопиялық және микроскопиялық күйлері
- •§14. Макрокүйдің ықтималдығы
- •§15. Канондық ансамбль. Гиббс таралуы
- •§16. Газ молекулаларының жылдамдықтары бойыншатаралуының Максвелл заңы
- •§17. Молекулалардың жылдамдықтың абсолюттік мәні бойынша таралуы. Молекулалардың орташа жылдамдықтары
- •§18. Перрен тәжірибесі
- •3. Термодинамиканың бірінші бастамасы
- •§19. Квазистатикалық процестер
- •§20. Макроскопиялық жұмыс
- •§21. Термодинамиканың бірінші бастамасы
- •§22. Ішкі энергия
- •§23. Жылу мөлшері
- •§24. Жылусыйымдылық
- •§25. Идеал газдың ішкі энергиясы. Джоуль заңы
- •§26. Адиабаттық процесс. Пуассон теңдеуі
- •§27. Газ көлемінің адиабаталық өзгерісі кезіндегі жұмыс
- •§28. Политроптық процесс
- •§29. Клеман және Дезорм әдісімен қатынасын анықтау*
- •§30. Газдардағы дыбыс жылдамдығы*
- •§31. Бернулли теңдеуі*
- •§32. Жіңішке саңлаудан шыққан газдың жылдамдығы
- •4.Термодинамиканың екінші бастамасы
- •§33. Қайтымды және қайтымсыз процестер
- •§34. Термодинамиканың екінші бастамасының әр түрлі тұжырымдамалары
- •§35. Карно циклі
- •§36. Температураның термодинамикалық шкаласы
- •§37 Клаузиус теңсіздігі. Энтропия
- •§38. Энтропияның өсу заңы
- •§39. Газдардың диффузиясы кезінде энтропияның өсуі. Гиббс парадоксі
- •§40.Термодинамикалық потенциалдар
- •§41. Энтропияның физикалық мәні. Энтропия және ықтималдылық
- •§42. Нернст теоремасы
- •§43. Термодинамикалық тепе теңдік шарттары
- •Газдардағы тасымалдау құбылыстары
- •§44. Еркін жүрудің орташа жолы
- •Нақты газдар
- •§47 Беттік керілу
- •§48Шектік бұрыштар. Жұғу және жұқпау
- •§49. Сұйықтың майысқан бетінің екі жағындағы қысымдар айырымы. Лаплас формуласы
- •§50. Фазалар және фазалық түрленулер
§38. Энтропияның өсу заңы
1. Жүйе тепе тең 1-күйден 2-тепе тең күйге өтсін (31-сурет), бірақ өту процесі қайтымсыз болсын (суретте қайтымсыз процесс штрих сызықпен I көрсетілген). Жүйені 2-күйден бастапқы 1-күйге квазистатикалық қандай да бір жолмен II қайтарайық. Клаузиустың теңсіздігі негізінде былай жазуға болады:


II процесі квазистатикалық болғандықтан

Сондықтан Клаузиус теңсіздігі мына түрге келеді:

Мұнда қоршаған ортаның температурасы. Осы температура кезінде ортадан жүйеге жылу мөлшері беріледі.
Егер жүйе адиабаталық оқшауланған болса, онда , және (38.1) интегралы нөлге тең болады. Онда
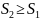 (38.2)
(38.2)
Адиабаталық
оқшауланған жүйенің энтропиясы азаймайды,
энтропия өсуі мүмкін немесе тұрақты
болып қалуы керек. Бұл – энтропияның
өсу заңы. Егер
 болса, онда адиабаттық оқшауланған
жүйенің 2-күйден 1-күйге өтуі мүмкін
емес, себебі бұл өту энтропияның кемуімен
жүрер еді. Керісінше, жүйенің энтропиясы
аз 1-күйден энтропиясы жоғары 2-күйге
адиабатты өтуі термодинамиканың
2-бастамасының постулатына қайшы
келмейді, демек, мүмкін. Осылай
термодинамиканың 2-бастамасы табиғатта
болатын процестің өту бағытын айқын
көрсетеді.
болса, онда адиабаттық оқшауланған
жүйенің 2-күйден 1-күйге өтуі мүмкін
емес, себебі бұл өту энтропияның кемуімен
жүрер еді. Керісінше, жүйенің энтропиясы
аз 1-күйден энтропиясы жоғары 2-күйге
адиабатты өтуі термодинамиканың
2-бастамасының постулатына қайшы
келмейді, демек, мүмкін. Осылай
термодинамиканың 2-бастамасы табиғатта
болатын процестің өту бағытын айқын
көрсетеді.
2 .
Энтропияның өсу заңын растайтын мысал
қарастырайық. Идеал газдың 1 молі
қабырғалары қатты адиабатты цилиндр
ішінде болсын (32-сурет). Цилиндр АВ қатты
қабырғасымен екі бөлікке бөлінген
болсын. Алғашында газ көлемі
болатын
бөлігінде болсын, ал ыдыстың екінші
жағында вакуум болсын. Содан кейін АВ
қабырғасы алып тасталсын немесе ол
қабырғада тесік жасалсын. Газ ыдыстың
екінші жағына аға бастайды. Ыдыстың екі
жағындағы қысым мен температура теңескен
соң бұл процесс тоқтайды. Осы процестің
қайтымды немесе қайтымсыз екендігін
анықтайық. Ол үшін энтропияның өзгерісін
есептеу керек. Бұл процесс кезінде
газдың ішкі энергиясы өзгермеуі керек,
себебі газ қатты адиабаттық қоршауда.
Джоуль заңына сай газдың температурасы
да өзгермеуі керек, себебі температура
газдың ішкі энергиясымен бірмәнді
анықталады. Процестің басындағы және
аяғындағы температура мәндерін Т деп,
ал
-бастапқы,
-соңғы
көлемдерді белгілейік. Газдың энтропиясының
өзгерісін есептеу үшін газды бастапқы
күйден соңғы күйге квазистатикалық
көшіру керек. Ол үшін газды температурасы
Т қыздырғышпен жылулық жанастырамыз.
Газға түсірілетін қысымды шексіз аз
азайта отырып оны изотермиялық көлемі
болатын соңғы күйге көшіреміз. Бұл кезде
газ қыздырғыштан жылу мөлшерін алып
оны эквивалентті жұмысқа айналдырады.
.
Энтропияның өсу заңын растайтын мысал
қарастырайық. Идеал газдың 1 молі
қабырғалары қатты адиабатты цилиндр
ішінде болсын (32-сурет). Цилиндр АВ қатты
қабырғасымен екі бөлікке бөлінген
болсын. Алғашында газ көлемі
болатын
бөлігінде болсын, ал ыдыстың екінші
жағында вакуум болсын. Содан кейін АВ
қабырғасы алып тасталсын немесе ол
қабырғада тесік жасалсын. Газ ыдыстың
екінші жағына аға бастайды. Ыдыстың екі
жағындағы қысым мен температура теңескен
соң бұл процесс тоқтайды. Осы процестің
қайтымды немесе қайтымсыз екендігін
анықтайық. Ол үшін энтропияның өзгерісін
есептеу керек. Бұл процесс кезінде
газдың ішкі энергиясы өзгермеуі керек,
себебі газ қатты адиабаттық қоршауда.
Джоуль заңына сай газдың температурасы
да өзгермеуі керек, себебі температура
газдың ішкі энергиясымен бірмәнді
анықталады. Процестің басындағы және
аяғындағы температура мәндерін Т деп,
ал
-бастапқы,
-соңғы
көлемдерді белгілейік. Газдың энтропиясының
өзгерісін есептеу үшін газды бастапқы
күйден соңғы күйге квазистатикалық
көшіру керек. Ол үшін газды температурасы
Т қыздырғышпен жылулық жанастырамыз.
Газға түсірілетін қысымды шексіз аз
азайта отырып оны изотермиялық көлемі
болатын соңғы күйге көшіреміз. Бұл кезде
газ қыздырғыштан жылу мөлшерін алып
оны эквивалентті жұмысқа айналдырады.
Изотермиялық процесс үшін
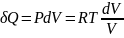 ,
,
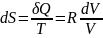 .
.
Осыдан энтропия өзгерісін былай анықтаймыз:
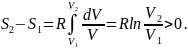
Демек, энтропия өсті. Сондықтан газдың бос кеңістікке адиабаталық ұлғаюы қайтымсыз процесс.
§39. Газдардың диффузиясы кезінде энтропияның өсуі. Гиббс парадоксі
1 .Газдардың
диффузиясы кезінде энтропияның өсуі.
Қатты
адиабатты қабырғалы жабық ыдыс ішінде
1 және 2 идеал газдары бар болсын. Ыдыстың
жалпы көлемі өзгермейді. Бастапқы
мезетте осы екі газ бір бірінен саңлаусыз
қабырғамен бөлінген және бірдей
температураға ие болсын. Саңлаусыз
қабырға алып тасталған соң газдар бір
бірімен араласып қайтымсыз процесс
жүреді. Соңында газдар бірқалыпты
араласқан соң, араласу процесі тоқтап
жүйе тепе тең күйге келеді. Соңғы күйдегі
жүйенің температурасы бастапқыдай
болады, себебі жүйе оқшауланған және
газдар идеал. Осы тәжірибенің нәтижесінде
жүйенің энтропиясы қалай өзгеретінін
қарастырайық. Жүйені бастапқы күйден
соңғы күйге өткізетін процесс үшін
термодинамика анықтамасы бойынша
энтропия
.Газдардың
диффузиясы кезінде энтропияның өсуі.
Қатты
адиабатты қабырғалы жабық ыдыс ішінде
1 және 2 идеал газдары бар болсын. Ыдыстың
жалпы көлемі өзгермейді. Бастапқы
мезетте осы екі газ бір бірінен саңлаусыз
қабырғамен бөлінген және бірдей
температураға ие болсын. Саңлаусыз
қабырға алып тасталған соң газдар бір
бірімен араласып қайтымсыз процесс
жүреді. Соңында газдар бірқалыпты
араласқан соң, араласу процесі тоқтап
жүйе тепе тең күйге келеді. Соңғы күйдегі
жүйенің температурасы бастапқыдай
болады, себебі жүйе оқшауланған және
газдар идеал. Осы тәжірибенің нәтижесінде
жүйенің энтропиясы қалай өзгеретінін
қарастырайық. Жүйені бастапқы күйден
соңғы күйге өткізетін процесс үшін
термодинамика анықтамасы бойынша
энтропия
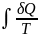 интегралын шешу арқылы анықталады. Бұл
процесс қандай болса да квазистатикалық
болуы шарт. Шын мәнінде бұл тәжірибедегі
екі газды бөліп тұрған қабырға алып
тасталғаннан кейінгі газдардың араласу
процесі квазистатикалық емес. Егер біз
қарастырып отырған екі газ бірдей
болмаса оларды квазистатикалық
араластыруға болады. Бұл процесті
мынадай жолмен іске асыруға болады.
Газдарды бастапқыда бөліп тұрған қабырға
идеал жартылай өткізетін қабаттасқан
екі aжәне
b
қабырғаларынан тұрсын (33-сурет).a
қабырғасы 1
газды кедергісіз өткізіп, 2
газды өткізбейтін болсын, ал b
қабырғасы 2
газды өткізіп 1
газды өткізбейтін болсын. Мұндай идеал
жартылай өткізетін қабырғалар шын
мәнінде жоқ. Бірақ, біз ой тәжірибесінде
солай болады деп қарастыруымызға болады.
Осы сипатталған aжәне
b
қабырғалары бастапқыда екі газды да
өткізбейді. Адиабаттық қоршауды алып
тастап жүйені температурасы
термостатпен жанастырайық. b
қабырғасын ығыстыру арқылы 1-газға
бастапқы
көлемнен соңғы
көлемге дейін квазистатикалық ұлғаюға
мүмкіндік берейік. Бұл жағдайда 1-газ
жұмыс атқарады. Газдың температурасы
өзгермеуі үшін оны термостатпен
жанастырамыз. Температура тұрақты
болғандықтан энтропия өсімшесін былай
анықтаймыз (§37-қара):
интегралын шешу арқылы анықталады. Бұл
процесс қандай болса да квазистатикалық
болуы шарт. Шын мәнінде бұл тәжірибедегі
екі газды бөліп тұрған қабырға алып
тасталғаннан кейінгі газдардың араласу
процесі квазистатикалық емес. Егер біз
қарастырып отырған екі газ бірдей
болмаса оларды квазистатикалық
араластыруға болады. Бұл процесті
мынадай жолмен іске асыруға болады.
Газдарды бастапқыда бөліп тұрған қабырға
идеал жартылай өткізетін қабаттасқан
екі aжәне
b
қабырғаларынан тұрсын (33-сурет).a
қабырғасы 1
газды кедергісіз өткізіп, 2
газды өткізбейтін болсын, ал b
қабырғасы 2
газды өткізіп 1
газды өткізбейтін болсын. Мұндай идеал
жартылай өткізетін қабырғалар шын
мәнінде жоқ. Бірақ, біз ой тәжірибесінде
солай болады деп қарастыруымызға болады.
Осы сипатталған aжәне
b
қабырғалары бастапқыда екі газды да
өткізбейді. Адиабаттық қоршауды алып
тастап жүйені температурасы
термостатпен жанастырайық. b
қабырғасын ығыстыру арқылы 1-газға
бастапқы
көлемнен соңғы
көлемге дейін квазистатикалық ұлғаюға
мүмкіндік берейік. Бұл жағдайда 1-газ
жұмыс атқарады. Газдың температурасы
өзгермеуі үшін оны термостатпен
жанастырамыз. Температура тұрақты
болғандықтан энтропия өсімшесін былай
анықтаймыз (§37-қара):

мұндағы
 -1-газдың
мольдер саны. Бұл кезде 2-газдың күйі
өзгермейді. Енді тура осы жолмен 2-газ
ыдыстың барлық көлемін алатындай
a-қабырғасын
ығыстырып 2-газды квазистатикалық
ұлғайтамыз. Бұл кезде 2-газдың энтропиясының
өсімшесі былай анықталады:
-1-газдың
мольдер саны. Бұл кезде 2-газдың күйі
өзгермейді. Енді тура осы жолмен 2-газ
ыдыстың барлық көлемін алатындай
a-қабырғасын
ығыстырып 2-газды квазистатикалық
ұлғайтамыз. Бұл кезде 2-газдың энтропиясының
өсімшесі былай анықталады:

мұндағы -1-газдың мольдер саны, ал оның бастапқы көлемі. Нәтижесінде жүйе бірқалыпты араласқан тепе тең күйге келеді. Демек, нақты тәжірибе нәтижесін алдық. Жүйенің толық энтропиясының өсімшесі былай анықталады:
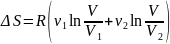 (39.1)
(39.1)
Бұл
өсімше оң мәнге ие, себебі
 және
және
 .
Энтропия өсті. Адиабаталық қоршаудағы
екі түрлі газ өздігінен араласуы, шынында
да, қайтымсыз процесс екендігін
дәлелдедік.
.
Энтропия өсті. Адиабаталық қоршаудағы
екі түрлі газ өздігінен араласуы, шынында
да, қайтымсыз процесс екендігін
дәлелдедік.
2.Гиббс
парадоксі.(39.1)
формуласы біртекті газдар үшін Гиббс
парадоксі деп аталатын қызық қорытындыға
алып келеді. Енді 1 және 2 газдар біртекті
деп қарастырайық. Бұл жағдайда да (39.1)
формуласына сәйкес энтропия өседі. a,
bқабаттасқан
жартылай өткізетін қабырғалардың екі
жағындағы газдар біртекті болсын және
олардың мольдер саны да бірдей болсын,
демек,
 және
және
 болсын, онда (39.1) формуласынан мынадай
нәтиже шығады:
болсын, онда (39.1) формуласынан мынадай
нәтиже шығады:
 .(39.2)
.(39.2)
Бұл жағдайда да энтропия өсті, бірақ жүйенің соңғы күйі мен бастапқы күйі еш айырмасыз қалды. Осы жағдай Гиббс парадоксі деп аталады.
Гиббс
парадоксін түсіну үшін (39.1) формуласы
тек әртекті газдар үшін қорытылғанын
ескеруіміз керек. (39.1) формуласын бірдей
газдарға қолдануға болмайды. Біз
қарастырған мысалдағы жартылай өткізетін
қабырғалардың біртекті газдар үшін
ешқандай маңызы жоқ. Себебі, бұл қабырғаның
екі жағындағы газдар бірдей. 1-ші газды
ғана өткізетін қабырға 2-газды да
өткізеді. Сондықтан біз қарастырған
әдіспен біртекті газдарды квазистатикалық
араластыру мүмкін емес. Біртекті газдар
үшін
 .
.
