
- •1. Температура
- •§1. Температура және термодинамикалық тепе-теңдік
- •§2 Термоскоп және температуралық нүктелер
- •§3 Температура шкалалары
- •2. Идеал газдың молекула-кинетикалық теориясы
- •§4.Идеал газ
- •§5. Газ қысымы. Молекула-кинетикалық теорияның негізгі теңдеуі
- •§6. Идеал газ күйінің теңдеуі
- •§7. Идеал газ заңдары
- •§8. Орташа квадраттық жылдамдық
- •Бақылау сұрақтары:
- •§9. Барометрлік формула
- •Бақылау сұрақтары:
- •§10. Больцман таралуы
- •§11. Ықтималдықтар теориясынан қысқаша түсінік
- •§12. Кездейсоқ шаманың орташа мәні. Ықтималдықтардың таралу функциясы
- •§13. Жүйенің макроскопиялық және микроскопиялық күйлері
- •§14. Макрокүйдің ықтималдығы
- •§15. Канондық ансамбль. Гиббс таралуы
- •§16. Газ молекулаларының жылдамдықтары бойыншатаралуының Максвелл заңы
- •§17. Молекулалардың жылдамдықтың абсолюттік мәні бойынша таралуы. Молекулалардың орташа жылдамдықтары
- •§18. Перрен тәжірибесі
- •3. Термодинамиканың бірінші бастамасы
- •§19. Квазистатикалық процестер
- •§20. Макроскопиялық жұмыс
- •§21. Термодинамиканың бірінші бастамасы
- •§22. Ішкі энергия
- •§23. Жылу мөлшері
- •§24. Жылусыйымдылық
- •§25. Идеал газдың ішкі энергиясы. Джоуль заңы
- •§26. Адиабаттық процесс. Пуассон теңдеуі
- •§27. Газ көлемінің адиабаталық өзгерісі кезіндегі жұмыс
- •§28. Политроптық процесс
- •§29. Клеман және Дезорм әдісімен қатынасын анықтау*
- •§30. Газдардағы дыбыс жылдамдығы*
- •§31. Бернулли теңдеуі*
- •§32. Жіңішке саңлаудан шыққан газдың жылдамдығы
- •4.Термодинамиканың екінші бастамасы
- •§33. Қайтымды және қайтымсыз процестер
- •§34. Термодинамиканың екінші бастамасының әр түрлі тұжырымдамалары
- •§35. Карно циклі
- •§36. Температураның термодинамикалық шкаласы
- •§37 Клаузиус теңсіздігі. Энтропия
- •§38. Энтропияның өсу заңы
- •§39. Газдардың диффузиясы кезінде энтропияның өсуі. Гиббс парадоксі
- •§40.Термодинамикалық потенциалдар
- •§41. Энтропияның физикалық мәні. Энтропия және ықтималдылық
- •§42. Нернст теоремасы
- •§43. Термодинамикалық тепе теңдік шарттары
- •Газдардағы тасымалдау құбылыстары
- •§44. Еркін жүрудің орташа жолы
- •Нақты газдар
- •§47 Беттік керілу
- •§48Шектік бұрыштар. Жұғу және жұқпау
- •§49. Сұйықтың майысқан бетінің екі жағындағы қысымдар айырымы. Лаплас формуласы
- •§50. Фазалар және фазалық түрленулер
§24. Жылусыйымдылық
1.Меншікті,
мольдік жылусыйымдылық.Дененің
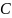 жылусыйымдылығы
деп дененің алған шексіз аз
жылу
мөлшерінің сол дененің температурасының
жылусыйымдылығы
деп дененің алған шексіз аз
жылу
мөлшерінің сол дененің температурасының
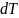 өсімшесіне
қатынасын айтамыз:
өсімшесіне
қатынасын айтамыз:
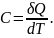 (24.1)
(24.1)
Егер заттың бірлік массасы қарастырылатын болса, онда меншікті жылусыйымдылық анықтамасы былай тұжырымдалады. Заттың бірлік массасының температурасын 1 градусқа өзгертуге қажетті жылу мөлшерін сол заттың меншікті жылусыйымдылығы деп атаймыз:
 (24.2)
(24.2)
Термодинамикада көбіне мольдік жылусыйымдылығы қолданылады. Заттың бір молінің температурасын 1 градусқа өзгертуге қажетті жылу мөлшерін сол заттың мольдік жылусыйымдылығы деп атаймыз:
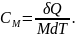 (24.3)
(24.3)
2.Көлем және қысым тұрақты болғандағы жылусыйымдылықтар. Егер термодинамиканың бірінші бастамасына (24.1) теңдеуді қойсақ, ондажылусыйымдылық үшін:

ал,
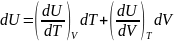 ,
,
болғандықтан,
 (24.4)
(24.4)
көлем
тек
температураға ғана емес, сондай-ақ
қысымға да тәуелді.Қысымның қалай
өзгергеніне байланысты
 кез келген мәнді қабылдауы мүмкін.
(24.4) өрнектің мағынасы бірмәнді болуы
үшін бұл қатынастың мәнін тұрақтандыру
керек. Бірақ жылусыйымдылықтың мәні
кез келген мәнді қабылдауы мүмкін.
(24.4) өрнектің мағынасы бірмәнді болуы
үшін бұл қатынастың мәнін тұрақтандыру
керек. Бірақ жылусыйымдылықтың мәні
 ÷
÷ аралығында кез келген мәнді қабылдауы
мүмкін. Мысалы, изотермиялық процесс
үшін сыйымдылықтың мәні
аралығында кез келген мәнді қабылдауы
мүмкін. Мысалы, изотермиялық процесс
үшін сыйымдылықтың мәні
 болады, себебі
болады, себебі
 ,
,
 .
Адиабаттық процесс үшін
,
.
Адиабаттық процесс үшін
,
 .
.
Сәйкесінше,
 және
және деп
белгіленетін көлем және қысым тұрақты
болғандағы жылусыйымдылықтар ерекше
маңызды. Егер көлем тұрақты болса, онда
,
бұдан
деп
белгіленетін көлем және қысым тұрақты
болғандағы жылусыйымдылықтар ерекше
маңызды. Егер көлем тұрақты болса, онда
,
бұдан
 (24.5)
(24.5)
Егер
қысым тұрақты болса, онда
қатынасы
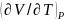 дербес
туындысына айналады. Бұл жағдайда (24.4)
формула мынадай нәтижеге алып келеді:
дербес
туындысына айналады. Бұл жағдайда (24.4)
формула мынадай нәтижеге алып келеді:
 (24.6)
(24.6)
Жылусыйымдылықтардың
 айырымы
үшін мынадай өрнек аламыз:
айырымы
үшін мынадай өрнек аламыз:
 (24.7)
(24.7)
жылусыйымдылығы
үшін өрнек алуға болады. Егер процесс
тұрақты қысымда өтетін болса, онда
энтальпияның анықтамасы бойынша
 .
Сондықтан
.
Сондықтан
 (24.8)
(24.8)
Бақылау сұрақтары:
Қандай физикалық шаманы жылусиымдылық деп атаймыз?
Меншікті жылу сиымдылығы қалай анықталады?
Тұрақты көлем кезіндегі жылусиымдылық қалай анықталады?
Тұрақты қысым кезіндегі жылусиымдылық қалай анықталады?
§25. Идеал газдың ішкі энергиясы. Джоуль заңы
1.Калориметриялық күй теңдеуі.Жалпы термодинамикалық қатынас-тардан нақты нәтижелер алу үшін біріншіден күй теңдеуін
 (25.1)
(25.1)
екіншіден, дененің күйін анықтайтын параметрлердің функциясы ретінде ішкі энергияны білу қажет, мысалы
 (25.2)
(25.2)
(25.2)өрнек түріндегі тәуелділік калориметриялық күй теңдеуі деп аталады, ал (25.1) өрнек түріндегі тәуелділік бізге белгілі – термиялық күй теңдеуі. Бұл екі тәуелділік тәжірибеде ғана анықталады.
2.Гей-Люссакжәне Джоуль тәжірибелері. Термодинамиканың бірінші бастамасының идеал газға қолдануын қарастырайық. Идеал газдардың термиялық күй теңдеуі – Менделеев-Клапейрон теңдеуі болып табылады.Бір моль идеал газ үшін бұл теңдеу мына түрде жазылады:

Ж үйенің
калориметриялық күй теңдеуін алу үшін
ішкі энергияның көлемге қалай тәуелді
екендігін анықтайық. Осы сұраққа жуықтау
жауап беретін тәжірибені Гей-Люссак
қойды. Көлемдері бірдей А
және В
мыс ыдыстар бір-бірімен С
краны бар түтікпен жалғасқан (20-сурет).
А
ыдысы ауамен толтырылған, В
ыдысының ауасы сорылып тасталған. С
кранын ашқан кезде ауа А
ыдыстан В
ыдысқа ағады. Гей-Люссак А
ыдысындағы ауаның температурасы
төмендегенін, ал В-дағы
ауаның температурасы артқанын байқайды.
Температураның мұндай өзгерісі А
ыдыстағы ауа өзінің ішкі энергиясы
есебінен ұлғайып жұмыс атқарғанымен
түсіндіріледі. А
және В
ыдыстарында тепе-теңдік орнағаннан
кейін олардың температурасы бастапқы
мәнімен теңеседі. Гей-Люссак тәжірибе
нәтижесінде көлем екі есе ұлғайғанда
температураның өзгермейтіндігін
көрсетті. Бұдан мынадай қорытынды
жасауға болады. Температура тұрақты
болса ішкі энергия көлемге тәуелсіз
болады. Осы тәжірибені аздаған
өзгерістермен Джоуль де орындаған.
үйенің
калориметриялық күй теңдеуін алу үшін
ішкі энергияның көлемге қалай тәуелді
екендігін анықтайық. Осы сұраққа жуықтау
жауап беретін тәжірибені Гей-Люссак
қойды. Көлемдері бірдей А
және В
мыс ыдыстар бір-бірімен С
краны бар түтікпен жалғасқан (20-сурет).
А
ыдысы ауамен толтырылған, В
ыдысының ауасы сорылып тасталған. С
кранын ашқан кезде ауа А
ыдыстан В
ыдысқа ағады. Гей-Люссак А
ыдысындағы ауаның температурасы
төмендегенін, ал В-дағы
ауаның температурасы артқанын байқайды.
Температураның мұндай өзгерісі А
ыдыстағы ауа өзінің ішкі энергиясы
есебінен ұлғайып жұмыс атқарғанымен
түсіндіріледі. А
және В
ыдыстарында тепе-теңдік орнағаннан
кейін олардың температурасы бастапқы
мәнімен теңеседі. Гей-Люссак тәжірибе
нәтижесінде көлем екі есе ұлғайғанда
температураның өзгермейтіндігін
көрсетті. Бұдан мынадай қорытынды
жасауға болады. Температура тұрақты
болса ішкі энергия көлемге тәуелсіз
болады. Осы тәжірибені аздаған
өзгерістермен Джоуль де орындаған.
3.Джоуль-Томсон құбылысы. Гей-Люссак пен Джоулдің тәжірибелерінің дәлдігі өте төмен болды. Себебі ауаның жылусыйымдылығы ыдыстар мен калориметрдегі судың жылусыйымдылықтарымен салыстырғанда аз болды. 1852-1862 жылдары Джоуль мен Томсон бірге жасаған тәжірибелері үлкен дәлдікпен орындалды. Бұл тәжірибелердің нәтижесінде тек қана ішкі энергияның көлемге тәуелділігі зерттеліп қоймай, сонымен қатар Джоуль-Томсон құбылысы деп аталатын маңызды физикалық құбылыс ашылды.
Д жоуль
және Томсон тәжірибесінде жылулық
оқшауланған цилиндр алынды. Цилиндрдің
ортасында MNжәнеM/N/
металл торлары арасына тығыз мақтадан
тығын орнатылды (21-сурет). Зерттелетін
газ жоғары қысымның әсерінен тығын
арқылы цилиндрдің екінші жағына өте
баяу сыздықтайды. Тығын арқылы өткендіктен
газдың ағыны ламинарлы болды. Газ ағысы
өте баяу болғандықтан оның кине-тикалық
энергиясын ескермеуге болады. Бұл
жағдайда кез келген уақыт мезетінде
тығынның екі жағындағы газ термодинамикалық
тепе-теңдікте болады. Жүйе жылулық
оқшауланғандықтан газ ағыны адиабатты
болды. Тығынның екі жағындағы газдың
және
қысымдары үнемі тұрақты болуы қамтамасыз
етілді. Тығын мен газ процесс кезінде
бір-бірімен жылу алмасады. Ал, процесс
стационар болғанда жылу алмасу тоқтап,
тығынның физикалық күйі, демек ішкі
энергиясы тұрақты болады. Стационар
ағыс кезінде тығынның бір жағында
жоуль
және Томсон тәжірибесінде жылулық
оқшауланған цилиндр алынды. Цилиндрдің
ортасында MNжәнеM/N/
металл торлары арасына тығыз мақтадан
тығын орнатылды (21-сурет). Зерттелетін
газ жоғары қысымның әсерінен тығын
арқылы цилиндрдің екінші жағына өте
баяу сыздықтайды. Тығын арқылы өткендіктен
газдың ағыны ламинарлы болды. Газ ағысы
өте баяу болғандықтан оның кине-тикалық
энергиясын ескермеуге болады. Бұл
жағдайда кез келген уақыт мезетінде
тығынның екі жағындағы газ термодинамикалық
тепе-теңдікте болады. Жүйе жылулық
оқшауланғандықтан газ ағыны адиабатты
болды. Тығынның екі жағындағы газдың
және
қысымдары үнемі тұрақты болуы қамтамасыз
етілді. Тығын мен газ процесс кезінде
бір-бірімен жылу алмасады. Ал, процесс
стационар болғанда жылу алмасу тоқтап,
тығынның физикалық күйі, демек ішкі
энергиясы тұрақты болады. Стационар
ағыс кезінде тығынның бір жағында
 ,
ал екінші жағында
,
ал екінші жағында
 температуралары
орнығады. Осы температуралар тәжірибе
кезінде өлшенген. Газдың тығын арқылы
стационар ағысы Джоуль-Томсон процесі
деп аталады, ал осындай ағыс кезінде
температураның өзгеруі Джоуль-Томсон
құбылысы деп аталады. Ағыс өте баяу
болғанымен бұл процесс квазистатикалық
емес, себебі жалпы жүйеде термодинамикалық
тепе-теңдік жоқ.
температуралары
орнығады. Осы температуралар тәжірибе
кезінде өлшенген. Газдың тығын арқылы
стационар ағысы Джоуль-Томсон процесі
деп аталады, ал осындай ағыс кезінде
температураның өзгеруі Джоуль-Томсон
құбылысы деп аталады. Ағыс өте баяу
болғанымен бұл процесс квазистатикалық
емес, себебі жалпы жүйеде термодинамикалық
тепе-теңдік жоқ.
4.
Тығынның сол жағында ойша ABNMкеңістігін
алып тұрған газдың
көлемін
қарастырайық (21-сурет). Тығыннан өткен
соң бұл газ оң жақтағы M/N/B/A/
кеңістіктегі
көлемді
алады. Осы процеске термодинамиканың
бірінші бастамасын қолданайық. AB
шекарасы MN
шекарасына жетеді. Бұл кезде газ үстінен
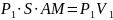 (S-цилиндрдің
көлденең қимасының ауданы) жұмысы
атқарылады.M/N/
шекарасы A/B/
орынына барады, газ
(S-цилиндрдің
көлденең қимасының ауданы) жұмысы
атқарылады.M/N/
шекарасы A/B/
орынына барады, газ
 жұмысын атқарады. Газдың атқарған толық
жұмысы
жұмысын атқарады. Газдың атқарған толық
жұмысы
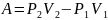 .
Газ сырттан жылу алған жоқ, себебі
цилиндр адиабаталық оқшауланған.
Тығынның физикалық күйі, ішкі энергиясы
өзгеріссіз қалған. Сондықтан
термодинамиканың бірінші бастамасын
осы процесс үшін былай жазамыз:
.
Газ сырттан жылу алған жоқ, себебі
цилиндр адиабаталық оқшауланған.
Тығынның физикалық күйі, ішкі энергиясы
өзгеріссіз қалған. Сондықтан
термодинамиканың бірінші бастамасын
осы процесс үшін былай жазамыз:

немесе
 .(25.3)
.(25.3)
Энтальпияның анықтамасы бойынша . Сондықтан (25.3) теңдік Джоуль-Томсон процесінде газдың энтальпиясы өзгермейтінін көрсетеді:
 .
(25.4)
.
(25.4)
5.Техникалық Джоуль-Томсон құбылысын тығынды қолданбай іске асыруға болады. Жоғары қысымда тұрған газды қысымы төмен кеңістікке вентиль немесе жіңішке саңлау арқылы ағуға мәжбүрлейді. Мұндай процесс газдың дроссельденуі деп аталады.Бұл процесс кезінде де энтальпия тұрақты болып қалады.
6.
Джоуль заңы.Джоуль-Томсон
тәжірибесінің нәтижелерін идеал газдың
ішкі энергиясының көлемге тәуелділігін
анықтауға қолданайық. Джоуль-Томсон
тәжірибесінде газдың стационар ағыны
кезінде тығынның екі жағындағы
температурасы өлшенген. Тәжірибе
нәтижесінде барлық газдың температуралары
төмендеді, ал сутегі үшін температура
аздап артқан. Температуралардың
 айырмасы
газ үшін Менделеев-Клапейрон теңдеуі
дәлірек орындалғанда азаяды, демек газ
идеал газ заңдарына дәлірек бағынған
сайыназаяды. Бұдан, идеал газдар үшін
болады
деп ескереміз. Бойль-Мариотт заңына
сәйкес
айырмасы
газ үшін Менделеев-Клапейрон теңдеуі
дәлірек орындалғанда азаяды, демек газ
идеал газ заңдарына дәлірек бағынған
сайыназаяды. Бұдан, идеал газдар үшін
болады
деп ескереміз. Бойль-Мариотт заңына
сәйкес
 ,
,
теңдеуі екендігін көрсетеді, басқаша жазсақ:
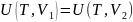 (25.5)
(25.5)
Сонымен, идеал газдың ішкі энергиясы тұрақты температура кезінде көлемге тәуелді емес. Басқаша айтқанда, идеал газ үшін ішкі энергия тек қана температураның функциясы болып табылады. Бұл тәжірибелік факт Джоуль заңы деп аталады.
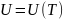 (25.6)
(25.6)
7.Роберт
Майер теңдеуі.
(24.7) теңдеуді идеал газ үшін қолданып
көрейік. Джоуль заңы бойынша
 ,
Менделеев-Клапейрон теңдеуінен -
,
Менделеев-Клапейрон теңдеуінен - .
Сондықтан, (23.7) теңдеуінен
.
Сондықтан, (23.7) теңдеуінен
 (25.7)
(25.7)
Осы маңызды қатынас Роберт Майер теңдеуі деп аталады.
25.7
теңдеуді шығарудың тағы бір жолын
қарастырайық. Поршенді цилиндрде идеал
газдың бір молі болсын. Поршенді бекітіп
қойыпгаз температурасын
-ға
арттырайық. Газ көлемі тұрақты болғандықтан
мұндай қыздыруға қажетті жылу мөлшері
 .
Бұл кезде жұмыс атқарылмайтын болғандықтан
бұл жылу мөлшері ішкі энергияның
өсімшесіне тең болады:
.
Бұл кезде жұмыс атқарылмайтын болғандықтан
бұл жылу мөлшері ішкі энергияның
өсімшесіне тең болады:
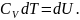 (25.8)
(25.8)
Енді
осы газбен басқа тәжірибе жасайық.
Газдың бастапқы күйі бірінші жағдайдағыдай
(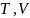 )
болсын. Бірақ поршенді бос жібереміз,
демек оған тұрақты сыртқы
қысым әсер етеді.
жылусыйымдылығының
анықтамасы бойынша газ температурасын
-ға
арттыру үшін
)
болсын. Бірақ поршенді бос жібереміз,
демек оған тұрақты сыртқы
қысым әсер етеді.
жылусыйымдылығының
анықтамасы бойынша газ температурасын
-ға
арттыру үшін
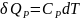 жылу мөлшері қажет. Бұл кезде
жұмысы
атқарылады. Қысым тұрақты болғандықтан
бұл жұмысты мына түрде жаза аламыз
жылу мөлшері қажет. Бұл кезде
жұмысы
атқарылады. Қысым тұрақты болғандықтан
бұл жұмысты мына түрде жаза аламыз .
Газдың ішкі энергиясы тек қана
температураға тәуелді болғандықтан,
оның шамасы бірінші жағдайдағыдай мәнге
өзгереді. Сондықтан екінші тәжірибеде
.
Газдың ішкі энергиясы тек қана
температураға тәуелді болғандықтан,
оның шамасы бірінші жағдайдағыдай мәнге
өзгереді. Сондықтан екінші тәжірибеде

немесе
 (25.9)
(25.9)
Осы теңдеудің екі жағын да -ға бөліп Роберт Майер теңдеуін аламыз:
 .
.
Бақылау сұрақтары:
Калориметриялық күй теңдеуі қандай параметрлерге тәуелді?
Гей-Люссак және Джоуль тәжірибелері қандай қорытындыға алып келді?
Джоуль-Томсон құбылысы қалай орындалады?
Техникалық Джоуль-Томсон құбылысын сипаттаңыз.
Идеал газдың ішкі энергиясы тұрақты температура кезінде көлемге тәуелді ме?
Идеал газ үшін ішкі энергия тек қандайпараметрдің функциясы?
Роберт Майер теңдеуін жазып көрсет.
