
- •Физическая и коллоидная химия
- •240125 «Технология производства и переработки пластических масс и эластомеров»
- •Содержание
- •1. Пояснительная записка
- •2. Тематический план
- •3. Методические указания по изучению дисциплины введение
- •Раздел 1. Физическая химия
- •Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний
- •Тема 1.2. Основы химической термодинамики
- •Тема 1.2.1. Первый закон термодинамики. Термохимия
- •Тема 1.2.2. Второй закон термодинамики
- •Тема 1.3. Химическая кинетика
- •Тема 1.4 катализ
- •Тема 1.5 химическое равновесие.
- •Тема 1.6. Фазовое равновесие
- •Тема 1.7. Растворы
- •Тема 1.8 электрохимия
- •Раздел 2. Основы коллоидной химии
- •Тема 2.1. Дисперсные системы
- •Тема 2.2. Растворы высокомолекулярных соедирений (вмс)
- •Задания для контрольной работы теоритические вопросы
- •Практические задачи
- •5. Литература Основная
- •Дополнительная
Тема 1.3. Химическая кинетика
Химическая кинетика - раздел физической химии, изучающий скорость и механизм химических реакций.
Скорость гомогенных химических реакций – это изменение концентрации реагирующих веществ во времени (моль/м3с).
Υ
=![]() (34)
(34)
Единица измерения скорости моль/(м3с) или моль/(л с).
Скорость зависит от концентрации реагентов, температуры, действия катализатора.
Основной закон кинетики – закон действующих масс:
![]() «При
постоянной температуре скорость данной
реакции прямо пропорциональна произведению
концентраций реагирующих веществ,
возведенных в некоторые степени». В
простейшем случае степень равна
коэффициенту, стоящему перед формулой
данного вещества. Например, для простой
реакции:
«При
постоянной температуре скорость данной
реакции прямо пропорциональна произведению
концентраций реагирующих веществ,
возведенных в некоторые степени». В
простейшем случае степень равна
коэффициенту, стоящему перед формулой
данного вещества. Например, для простой
реакции:
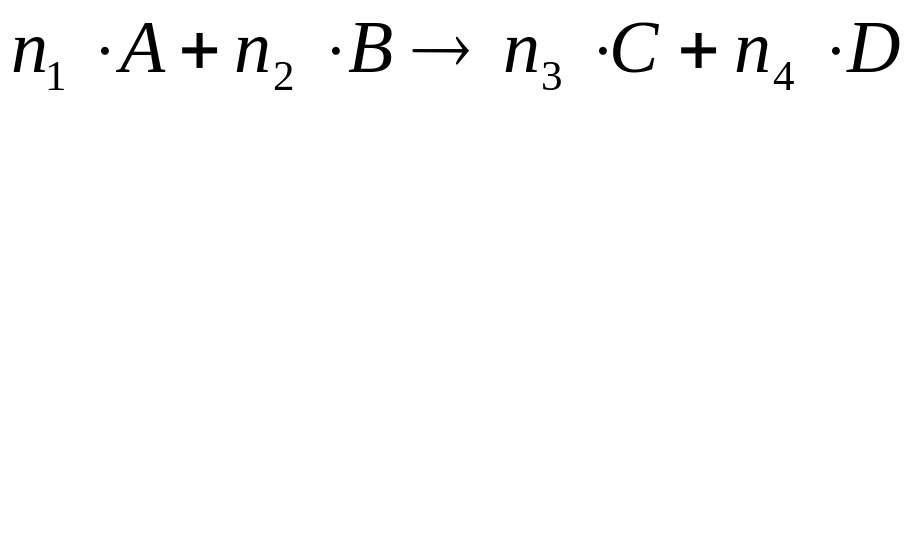 k–
константа скорости реакции
k–
константа скорости реакции
Правило Вант-Гоффа: при повышении температуры на 100С скорость реакции увеличивается в 2 - 4 раза
![]() (36)
(36)
где 2 – скорость реакции при температуре t2, 1 – скорость реакции при температуре t1, – температурный коэффициент, он принимает значения от 2 до 4. Скорость реакции обратно пропорциональна времени:
![]()
τ1/τ2=γ t (2) - t (1) /10 (37)
где τ – время;
t – температура
Пример 1. Реакция идет по уравнению: 3А + В = С + Д. Как следует изменить концентрацию В, чтобы при увеличении концентрации А в 2 раза скорость реакции возросла в 4 раза ? Реакцию считать простой.
Решение. Обозначим концентрацию реагирующих веществ [A]=a, [B]=b. Согласно закону действия масс ω1=ka3b. После увеличения концентрации А в 2 раза, концентрации и скорости соответственно стали: [А]=2а, [В]=bx; ω2=k(2a)3bх. По условию ω2=4 ω1. Поэтому имеем k(2a)3=4ka3b. Решаем полученное уравнение. K8a3bx=4ka3b; bx=4ka3b/8ka3=b/2. Концентрацию [B] нужно уменьшить в 2 раза.
Пример 2. Во сколько раз изменится скорость прямой реакции в системе
2SO2 (г)+О2 (г)2SO3 (г), если объем газовой смеси уменьшить в три раза?
Решение.
Обозначим концентрации реагирующих
веществ: [SO2]=a,
[O2]=b.
Согластно закону действия масс ω1=ka2b.
После уменьшения объема системы в три
раза концентрация исходных веществ
увеличится в три раза. [SO2]=3a,
[O2]=3b;
ω2=k(3a)33b.
Отсюда
![]() ,
т.е. скорость прямой реакции возрастает
в 27 раз.
,
т.е. скорость прямой реакции возрастает
в 27 раз.
Вопросы для самоконтроля:
Что изучает кинетика?
Что называется скоростью реакции? По изменению, концентрации какого вещества обычно определяют ее?
В чем заключается закон действующих масс?
От каких факторов зависит скорость химической реакции, константа скорости?
Тема 1.4 катализ
Катализ – это ускорение химического процесса под действием веществ-катализаторов, участие которых в процессе не учитывается общим стехиометрическим уравнением реакций. Характеристикой катализаторов служат их активность и селективность. Активность катализатора описывает ускорение данной реакции по сравнению с протеканием ее без него в тех же условиях (Ак), а в случае гетерогенного катализа – временем контакта (τк).
Катализатор – вещество, изменяющее скорость химической реакции и остающееся к концу реакции неизменным количественно и химически. Катализатор может быть положительным – если он увеличивает скорость реакции, отрицательным – если замедляет. От катализатора необходимо отличать инициаторы.
Инициатор – это вещества, ускоряющие химическую реакцию, но входящие в состав конечных продуктов. Отсюда катализ может быть положительным или отрицательным.
Различают катализ:
Гомогенный – реагирующие вещества и катализатор находятся в одной фазе:
гетерогенный – реагирующие вещества и катализатор находятся в разных фазах: есть граница раздела.
Автокатализ – особый вид катализа – когда катализатор образуется в результате химической реакции:
Сначала реакция идет медленно, но по мере накопления NO скорость реакции увеличивается.
Процесс самопроизвольного концентрирования вещества на поверхности какого-либо тела называется адсорбцией (поглощением).
Адсорбция бывает на границе разделов фаз: жидкость-жидкость: газ-жидкость; твердое тело-жидкость.
Особенности адсорбции: самопроизвольный процесс, т.е G<0; экзотермический процесс ∆H<0; носит избирательный характер – активированный уголь поглощает уксусную кислоту, но не поглощает воду.
Вопросы для самоконтроля.
Что называется сорбцией, абсорбцией, адсорбцией?
Что называется катализатором? Как вы понимаете положительный катализатор, ингибитор?
Чем катализатор отличатся от инициатора?
Какие виды катализа вы знаете?
В чем особенности катализаторов?
