
- •1. Химическая кинетика
- •1.1. Кинетика простых реакций
- •1.2. Кинетика сложных реакций
- •1.2.1. Обратимые реакции
- •1.2.2. Параллельные реакции
- •1.2.3. Последовательные реакции
- •1.2.4. Метод квазистационарных концентраций
- •1.2.5. Термодинамический аспект теории активированного
- •1.3. Примеры решения задач
- •Решение
- •Задача 3
- •Задача 6
- •Задача 7 Превращение роданистого аммония в тиомочевину − обратимая мономолекулярная реакция
- •Задача 11
- •Решение
- •Задача 12
- •Задача 13
- •Решение
- •3. Расчет ионных равновесий
- •Расчет ионных равновесий в гомогенных
- •3.2. Расчет гетерогенных ионных равновесий
- •3.3. Примеры решения задач
- •4. Электрическая проводимость
- •4.1. Общие сведения
- •4.2. Примеры решения задач
- •5. Электродные процессы
- •5.1. Равновесные электродные процессы. Классификация электродов
- •5.2. Вычисление эдс гальванического элемента
- •5.3. Зависимость эдс от температуры
- •5.4. Примеры решения задач
- •Часть 2
- •620002, Екатеринбург, Мира, 19
Задача 6
Определите число реакторов идеального смешения (каждый объемом 1 м3), установленных каскадом, чтобы при постоянной скорости подачи реакционной смеси 0,8 м3/с для осуществления реакции первого порядка с константой скорости 1 с−1 получить на выходе из последнего реактора концентрацию исходного вещества менее 5 % от начальной.
Решение
Уравнение зависимости концентрации вещества А от времени при протекании в реакторе идеального смешения реакции первого порядка с константой скорости k при заданной скорости подачи реакционной смеси v и объеме реактора V имеет вид
![]() .
.
Стационарное состояние достигается быстро, и тогда можно рассчитать
![]() .
.
Концентрация на выходе из первого реактора каскада соответствует начальной концентрации для второго реактора в каскаде и т. д. Краткий ответ: нужно четыре реактора.
Задача 7 Превращение роданистого аммония в тиомочевину − обратимая мономолекулярная реакция
![]() .
.
За изменением количества прореагировавшего роданида аммония стали наблюдать спустя некоторое время после начала реакции, причем отсчет времени начали с момента определения количества роданида в первый раз:
Время определения, мин |
0 |
19 |
38 |
48 |
60 |
Количество прореагировавшего роданида аммония, % |
2,0 |
6,9 |
10,4 |
12,3 |
13,6 |
При достижении состояния равновесия 21,2% роданистого аммония превратилось в тиомочевину.
Найти константу скорости прямой и обратной реакции, а также время от начала реакции до начала наблюдения.
Решение
Запишем приведенную в условии задачу в символьном варианте
![]()
Общий вид кинетической кривой обратимой реакции приведен на рис. 2.2.

Рис. 2.2
Запишем балансовые соотношения для исходного вещества и для продукта реакции
![]() ;
;
![]() .
.
Обратимой реакции первого порядка соответствует интегральное кинетическое уравнение
![]() .
.
Известно,
что
![]() =
21,2% .
=
21,2% .
Приведем данные таблицы к виду, удобному для подстановки в интегральное кинетическое уравнение
Время определения, мин |
0 |
19 |
38 |
48 |
60 |
|
2,0 |
6,9 |
10,4 |
12,3 |
13,6 |
Строим графическую зависимость от времени (рис.2.3):
![]()
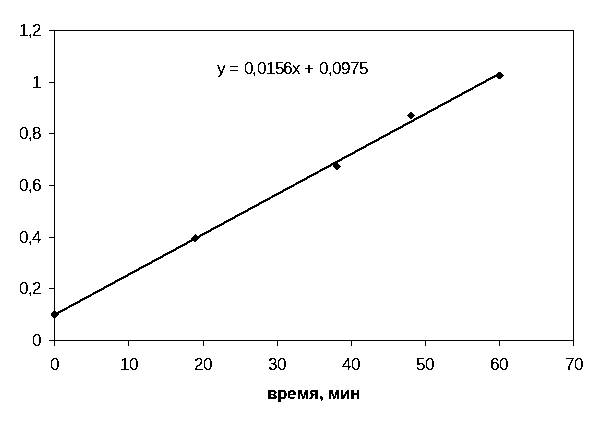
Рис.2.3
Угловой
коэффициент прямой равен
![]() = 0,0156 мин−1
.
= 0,0156 мин−1
.
Константа равновесия связана с константами скоростей прямой и обратной реакций
 .
.
Решая систему
= 0,0156 мин−1;
![]() ,
,
можно найти константы скоростей по отдельности.
Задача 8
Для обратимой реакции первого порядка константа равновесия равна 8, а константа скорости прямой реакции 0,4 с−1 . Начальная концентрация вещества В равна 0. Вычислите время, при котором концентрации веществ А и В станут равными.
Решение
Известно соотношение между константой равновесия обратимой реакции и константами скоростей прямой и обратной стадий:
![]() .
.
Отсюда
находим
![]() .
.
Интегральное уравнение скорости обратимой реакции первого порядка имеет вид:
![]() .
.
Величину предельной плотности глубины реакции можно найти как:
![]() .
.
По
условию задачи нужно выразить время,
при котором концентрации веществ А
и В
станут равными, т.е. x
=
![]() .
.
Задача 9
Константа скорости прямой и обратной реакций равны, соответственно, 15 с−1 и 1 с−1 . Вычислить текущие концентрации вещества А и В через 0,08 с после начала реакции, если начальные концентрации А и В равны 0,02 моль/л.
Решение
Текущие концентрации вещества А и В могут быть найдены по балансовым соотношениям:
![]() ;
;
![]() .
.
Интегральное кинетическое уравнение обратимой реакции имеет вид
,
где величина равновесной плотности глубины реакции находится как
.
Используя все эти уравнения и данные условия задачи, находим плотность глубины реакции, наблюдаемую через 0,08 с после начала реакции x , а затем и текущие концентрации участников реакции.
Задача 10
Кинетика обратимой реакции первого порядка исследована при двух температурах. Получены следующие данные:
При 293 К
Время, мин |
0 |
15 |
|
Содержание В в смеси в % |
2 |
43,3 |
57,8 |
При 313 К
Время, мин |
0 |
9 |
|
Содержание В в смеси в % |
2 |
55,6 |
62,8 |
Найдите энергии активации прямой и обратной реакций.
Решение
По
таблице, данной в условии задачи, при
293 К равновесная плотность глубины
реакции
![]()
![]() =0,587
=0,587![]() ,
а равновесные концентрации веществ
равны
=
0,578
,
а равновесные концентрации веществ
равны
=
0,578
![]() ,
а
,
а
![]() =
(1−0,578)
.
=
(1−0,578)
.
Исходя из этих данных, решаем систему уравнений:
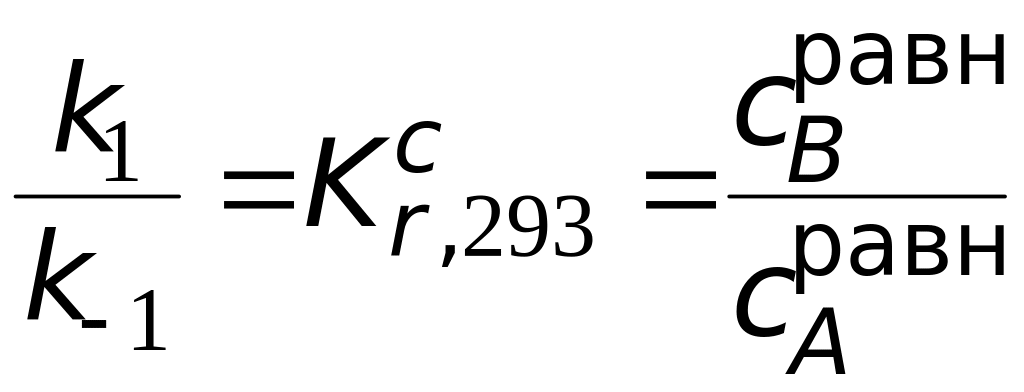
 ;
;
![]()
И находим константы скорости прямой и обратной реакций при 293 К. Затем ту же процедуру проводим с данными о реакции при 313 К. По таблице при 313 К 0,628 , = 0,628 , а = (1−0,628) . Затем, располагая данными о значениях констант скоростей прямой и обратной стадий при двух температурах, нетрудно найти и величины энергий активации.
