
- •1. Химическая кинетика
- •1.1. Кинетика простых реакций
- •1.2. Кинетика сложных реакций
- •1.2.1. Обратимые реакции
- •1.2.2. Параллельные реакции
- •1.2.3. Последовательные реакции
- •1.2.4. Метод квазистационарных концентраций
- •1.2.5. Термодинамический аспект теории активированного
- •1.3. Примеры решения задач
- •Решение
- •Задача 3
- •Задача 6
- •Задача 7 Превращение роданистого аммония в тиомочевину − обратимая мономолекулярная реакция
- •Задача 11
- •Решение
- •Задача 12
- •Задача 13
- •Решение
- •3. Расчет ионных равновесий
- •Расчет ионных равновесий в гомогенных
- •3.2. Расчет гетерогенных ионных равновесий
- •3.3. Примеры решения задач
- •4. Электрическая проводимость
- •4.1. Общие сведения
- •4.2. Примеры решения задач
- •5. Электродные процессы
- •5.1. Равновесные электродные процессы. Классификация электродов
- •5.2. Вычисление эдс гальванического элемента
- •5.3. Зависимость эдс от температуры
- •5.4. Примеры решения задач
- •Часть 2
- •620002, Екатеринбург, Мира, 19
Задача 3
Константа скорости разложения органической кислоты зависит от температуры следующим образом:
Т, К k · 102 , с 1
275 5,45
287 10,54
293 12,78
303 22,20
Определить графически параметры уравнения Аррениуса.
Решение
Уравнение Аррениуса имеет вид
![]() ,
,
где
k
− константа
скорости реакции;
предэкспоненциальный множитель;
![]()
эмпирически найденная энергия активации.
эмпирически найденная энергия активации.
Представив это уравнение в логарифмическом виде, получим
![]() , или
, или
![]() .
(1.2)
.
(1.2)
Последнее
выражение особенно удобно для графического
построения. Линейная зависимость
получается, если экспериментальные
данные представить в координатах ln
k
−
![]() .
Как следует из анализа уравнения (1.2),
угловой коэффициент прямой в этих
координатах будет равен
.
Как следует из анализа уравнения (1.2),
угловой коэффициент прямой в этих
координатах будет равен
![]() .
.
Переводим данные условия задачи к виду, необходимому для построения графической зависимости (табл. 1.2).
Таблица 1.2
Величина |
Значения |
|||
k ·102 , с 1 |
5,45 |
10,54 |
12,78 |
22,20 |
Т, К |
275 |
287 |
293 |
303 |
ln k |
−2,91 |
−2,25 |
−2,06 |
−1,51 |
103/Т, К−1 |
3,64 |
3,48 |
3,41 |
3,30 |
Строим графическую зависимость ln k − (рис.1.7), определяем угловой коэффициент прямой и находим величину энергии активации.
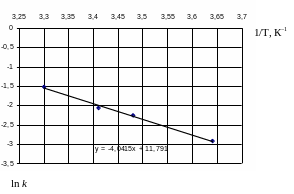
Рис. 1.7
При компьютерном построении рисунков возможно проводить линеаризацию экспериментальных данных, используя линию тренда соответствующей формы − в данном случае линейной. Тогда из уравнения линии тренда, которое появляется на плоскости рисунка, сразу виден угловой коэффициент прямой. Для нашей задачи он равен −4,0415. Отсюда энергия активации равна 33 601 Дж/моль.
Величина
предэкспоненциального множителя
довольно легко определяется из уравнения
линии тренда:
![]() = 11,791.
= 11,791.
Следовательно, = 1,32∙105 с−1.
Задача 4
Какая доля новокаина (%) разложится за 10 суток его хранения при 293 К, если константа скорости гидролиза новокаина при 313 К равна 1 105 сут1, а энергия активации реакции 55,2 кДж/моль.
Решение
Уравнение Аррениуса в дифференциальной форме
![]() .
.
Берем определенный интеграл
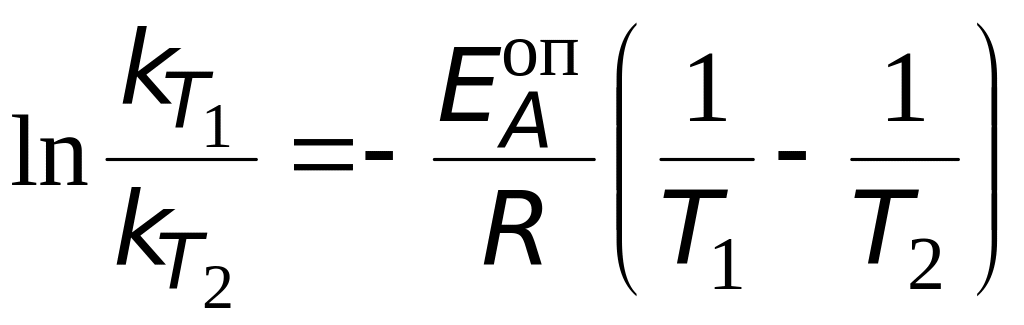 ,
или
,
или
![]() .
.
Отсюда находим неизвестную константу скорости:
![]() .
.
Предполагая, что новокаин разлагается по реакции первого порядка, воспользуемся интегральным уравнением реакции первого порядка:
![]() .
.
Нас
интересует, какая доля разложится, т.
е. 1 −
![]() .
.
Задача 5
Вычислите значение энергии активации, при которой температурный коэффициент скорости некоторой реакции в интервале температур от 27 оС до 37 оС равен 2,5. На сколько градусов нужно повысить температуру реакции, чтобы ее скорость увеличилась в 100 раз?
Решение
Температурный коэффициент скорости реакции
![]() = 2,5.
= 2,5.
![]() .
.
Энергия активации равна 70 848 Дж/моль.
Воспользуемся уравнением Аррениуса в интегральной форме:
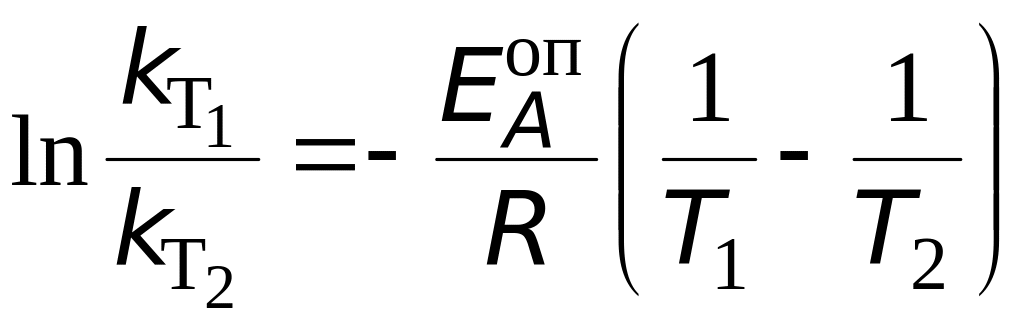 .
.
Считая, что все остальные условия в двух сравниваемых опытах одинаковы (концентрация, давление, растворитель и т. д.), находим
![]() .
.
![]() .
.
Далее
следует определить
![]() .
.
