
- •1. Химическая кинетика
- •1.1. Кинетика простых реакций
- •1.2. Кинетика сложных реакций
- •1.2.1. Обратимые реакции
- •1.2.2. Параллельные реакции
- •1.2.3. Последовательные реакции
- •1.2.4. Метод квазистационарных концентраций
- •1.2.5. Термодинамический аспект теории активированного
- •1.3. Примеры решения задач
- •Решение
- •Задача 3
- •Задача 6
- •Задача 7 Превращение роданистого аммония в тиомочевину − обратимая мономолекулярная реакция
- •Задача 11
- •Решение
- •Задача 12
- •Задача 13
- •Решение
- •3. Расчет ионных равновесий
- •Расчет ионных равновесий в гомогенных
- •3.2. Расчет гетерогенных ионных равновесий
- •3.3. Примеры решения задач
- •4. Электрическая проводимость
- •4.1. Общие сведения
- •4.2. Примеры решения задач
- •5. Электродные процессы
- •5.1. Равновесные электродные процессы. Классификация электродов
- •5.2. Вычисление эдс гальванического элемента
- •5.3. Зависимость эдс от температуры
- •5.4. Примеры решения задач
- •Часть 2
- •620002, Екатеринбург, Мира, 19
1.2.3. Последовательные реакции
Последовательные реакции − это такие реакции, которые состоят из последовательных элементарных стадий. Промежуточные вещества, которые образуются в одной стадии, расходуются в последующей.
Обычно очень трудно рассчитать концентрацию промежуточного вещества в любое время. Аналитические выражения получены только для последовательных реакций с двумя односторонними мономолекулярными элементарными стадиями.
Последовательную реакцию можно изобразить схематично как
![]()
или в виде системы стадий:
![]() ,
закон скорости
,
закон скорости
![]() ;
;
![]() ,
закон скорости
,
закон скорости
![]() .
.
где
![]()
скорости и константы скоростей первой
и второй стадий реакции соответственно;
скорости и константы скоростей первой
и второй стадий реакции соответственно;
![]()
концентрации исходного вещества и
промежуточного вещества соответственно.
Чтобы найти в явном виде зависимость
концентрации исходного вещества и
промежуточного вещества соответственно.
Чтобы найти в явном виде зависимость
![]() от времени, нужно проинтегрировать
дифференциальное кинетическое уравнение
для первой стадии.
от времени, нужно проинтегрировать
дифференциальное кинетическое уравнение
для первой стадии.
Дифференциальное кинетическое уравнение первой стадии
![]() .
.
Интегральное кинетическое уравнение первой стадии
![]() .
.
Уравнение кинетической кривой для исходного вещества
![]() .
.
Суммарная скорость образования промежуточного вещества равна алгебраической сумме скоростей образования вещества P в первой стадии и расходования его во второй стадии. Запишем ее с учетом знаков:
![]() .
.
![]() .
.
Для того чтобы
решить дифференциальное уравнение,
преобразуем его следующим образом:
сгруппируем переменные и умножим обе
части уравнения на величину
![]() .
При этом нужно учесть, что в левой части
.
При этом нужно учесть, что в левой части
![]() .
.![]()
Теперь получим
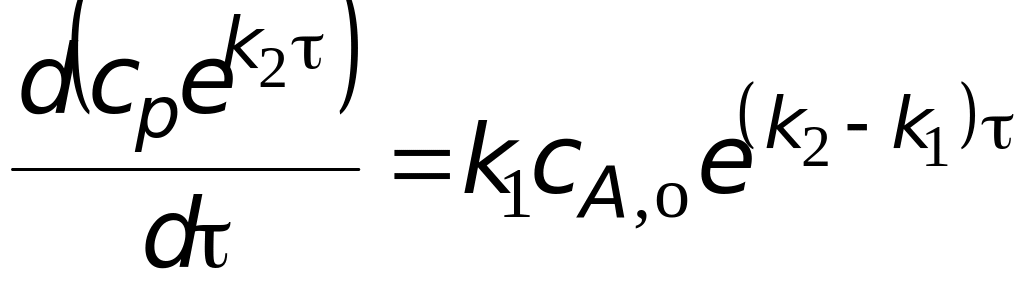 .
(1.7)
.
(1.7)
Интегрирование
уравнения (1.7) от 0 до
![]() и от 0 до
и от 0 до
![]() приводит к выражению
приводит к выражению
![]() .
(1.8)
.
(1.8)
Теперь из уравнения (1.8) легко выразить в явном виде зависимость концентрации промежуточного вещества от времени:
![]() .
.
Уравнение кинетической кривой для продукта последовательной реакции можно получить как интегрированием соответствующего дифференциального уравнения, так и по уравнению материального баланса, так как выражения кинетической кривой для исходного вещества и для промежуточного продукта мы только что вывели. Этот способ проще, им и воспользуемся.
В любой момент
времени
![]() .
.
Следовательно, легко получить
![]() .
.
Общий вид
кинетических кривых представлен на
рис. 1.5, где 1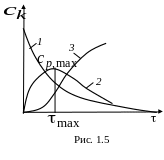 – зависимость концентрации исходного
вещества от времени; 2
– то же промежуточного вещества от
времени; 3
– то же продукта реакции от времени.
– зависимость концентрации исходного
вещества от времени; 2
– то же промежуточного вещества от
времени; 3
– то же продукта реакции от времени.
Как видно из рис. 1.5, на кинетической кривой промежуточного вещества 2 имеется максимум, а на кинетической кривой продукта – некоторый период с очень малой скоростью реакции, так называемый индукционный период. В этот период идет в системе накопление промежуточного продукта (его еще мало) и конечного продукта в системе почти нет.
Легко видеть из расположения кривых, что максимум на кривой промежуточного продукта совпадает по времени с точкой перегиба на кривой конечного продукта. Кинетическая кривая такого вида, какой имеет кинетическая кривая конечного продукта 3, называется s-образной кривой. Часто такие кривые наблюдаются при автокаталитических реакциях.
Конечно, если мы говорим о максимумах и о точках перегиба, то, имея уравнения линий, мы легко найдем координаты максимума и точки перегиба. Например, найдем координаты максимума на кинетической кривой промежуточного продукта и проанализируем, от каких факторов зависят высота максимума и время достижения максимума.
В точке максимума первая производная уравнения кривой равна нулю
![]() .
.
![]() .
.
Отсюда можно получить следующее выражение для времени максимума:
![]() , где
, где
![]() .
.
Теперь можно найти и максимальную концентрацию промежуточного вещества.
![]() .
.
Преобразуем
показатели степени, учитывая, что
![]()
![]() .
.
П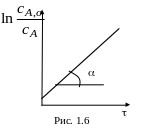 роанализировав
полученные координаты максимума на
кинетической кривой промежуточного
вещества, можно сделать вывод, что высота
максимума не зависит от абсолютных
значений констант скоростей стадий, а
зависит лишь от их соотношения. С ростом
отношения
роанализировав
полученные координаты максимума на
кинетической кривой промежуточного
вещества, можно сделать вывод, что высота
максимума не зависит от абсолютных
значений констант скоростей стадий, а
зависит лишь от их соотношения. С ростом
отношения
![]() максимум на кривой смещается к началу
координат и становится ниже.
максимум на кривой смещается к началу
координат и становится ниже.
Константу скорости первой стадии найдем путем линеаризации экспериментальных данных по первой стадии (рис. 1.6).
![]() .
.
Константу скорости второй стадии найдем из соотношения
![]() .
.
