
- •Опыты к экзаменационным билетам Билет №1
- •Билет №4
- •Билет №5
- •Билет №7
- •Билет №8
- •Билет №10
- •Билет №13
- •Билет №14
- •Билет №16
- •Билет №17
- •Билет №19
- •Билет №20
- •Билет №22
- •Билет №23
- •Билет №24
- •Билет №25
- •Гранулу цинка (стружку магния, гранулу алюминия) и раствор соляной кислоты, нагреть;
- •Раствор гидроксида натрия, несколько капель фенолфталеина (раствор станет малиновым) и раствор соляной кислоты;
- •Карбонат натрия (раствор) или карбонат кальция и раствор соляной кислоты (выделение пузырьков газа).
Билет №10
Получение и собирание водорода. Доказательство наличия этого газа в приборе.
В лаборатории водород получают взаимодействием металлов средней активности (от магния до водорода) с кислотой (серной или соляной).
Получим водород взаимодействием цинка (обычно, для быстрой реакции, берут магний) с соляной кислотой. Для этого в пробирку поместим несколько гранул цинка (стружек магния), нальём кислоту. (Пробирка закрывается пальцем до получения необходимого количества водорода.)
Уравнение реакции:
Zn + 2HCl → ZnCl2 + H2↑
восстановитель |
Zn0 – 2e → Zn2+ |
процесс окисления |
окислитель |
2H+ +2e → H20 |
процесс восстановления |
Если реакция идет медленно, то реакционную смесь необходимо нагреть. Для этого пробирку укрепляют в лапке, устанавливают снизу спиртовку и недолго нагревают пробирку. (До бурного выделения пузырьков газа).
Для доказательства наличия водорода в пробирке, куда мы её собирали, необходимо к горлышку пробирки поднести горящую спичку (если послышится лающий хлопок, то это взрывается загрязнённый водород, а чистый водород горит синем пламенем).
Уравнение реакции:
2H2 + O2 → 2H2O
Для комиссии:
Написать все уравнения реакций, указать окислитель и восстановитель.
Провести реакции в соответствии с правилами техники безопасности.
Объяснить наблюдаемые явления.
Билет №13
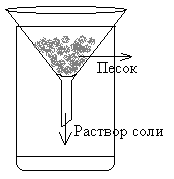
Выделение чистой поваренной соли из выданной смеси ее с речным песком.
Часто вещества нуждаются в очистке. Посмотрим пример очистки поваренной соли от речного песка.
Очистка поваренной соли от песка основывается на различных физических свойствах данных веществ. Во-первых, соль и песок обладают различной растворимостью в воде, во-вторых, раствор соли легко проникает через поры фильтровальной бумаги. Поэтому первая часть разделения данной смеси происходит следующим образом, в стакане в небольшом количестве воды растворяют максимальное количество смеси песка и соли, полученный раствор фильтруют через бумажный фильтр (раствор через поры проходит, а песок – нет).
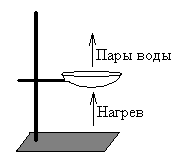
После получения чистого раствора соли возникает необходимость разделения соли и воды. Для этого используют метод выпаривания. Раствор наливают в чашку для выпаривания (не более 1/3 чашки) и аккуратно нагревают над пламенем спиртовки (см. рисунок). Со временем вода испаряется, соль остаётся.
Для комиссии:
Провести опыт в соответствии с правилами техники безопасности.
Объяснить наблюдаемые явления.
Билет №14
Проведение реакций, позволяющих осуществить следующие превращения:
растворимая соль → нерастворимое основание → оксид металла.
Цепочку данных превращений можно проследить на примере соли меди (II).
1. При добавлении к ней щёлочи образуется нерастворимое основание гидроксида меди (II) (выпадет голубой осадок).
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2OH- → Cu(OH)2↓
2. При нагревании образовавшийся гидроксид разлагается на оксид металла и воду.
Cu(OH)2 → CuO + H2O
Для комиссии:
Написать все уравнения реакций, для первого молекулярное и ионное уравнения.
Провести реакции в соответствии с правилами техники безопасности.
Объяснить наблюдаемые явления.
