
- •Часть II
- •Содержание
- •Лабораторная работа № 4
- •Ферменты
- •Отличие ферментов от неорганических катализаторов
- •Номенклатура и классификация ферментов
- •Коферменты
- •Свойства и функции коферментов
- •Специфичность ферментов
- •Изоферменты
- •Сравнительное действие ферментов и катализаторов неорганической природы
- •Лабораторная работа № 5
- •Активный центр фермента
- •Молекулярные механизмы ферментативного катализа
- •Мультисубстратные комплексы
- •Количественное определение ферментативной активности
- •Факторы, влияющие на активность ферментов
- •Регуляция каталитической активности ферментов
- •Регуляция путем изменения биосинтеза ферментов
- •Компартментализация ферментов в клетке
- •Лабораторная работа № 6
- •Кинетика ферментативных реакций
- •Уравнение Михаэлиса-Ментен
- •Графическое определение константы Михаэлиса (Кm)
- •Упростив уравнение, получаем:
- •Ингибирование активности ферментов
- •Конкурентное ингибирование аналогами субстрата
- •Графическая оценка констант конкурентного ингибирования
- •Бесконкурентное ингибирование
Графическое определение константы Михаэлиса (Кm)
Графически константа Михаэлиса может быть представлена, как это показано на рис. 6.1. Однако в случае многих ферментов определение Vmax и КM непосредственно из графика зависимости V0 от [S] (рис. 6.1) оказывается затруднено. Для большего удобства уравнение Михаэлиса-Ментен было преобразовано Лайнуивером и Берком в координатах двойных обратных величин:
![]()
Правую часть уравнения представляют в виде суммы двух слагаемых:
![]()
Упростив уравнение, получаем:
![]()
Как можно видеть, это уравнение представляет собой уравнение прямой:
у = ах + b,
где у = 1/V0 и х = 1/[S].
Если построить график зависимости у (т.е. 1/V0) от х (т.е. 1/[S]), то длина отрезка b, отсекаемого на оси у, будет равна 1/Vmax, а тангенс угла наклона – а равен величине KM/Vmax. Длину отрезка, отсекаемого на оси х (в области отрицательных значений), можно получить, приравняв к нулю. Тогда получим:
![]()
График уравнения Михаэлиса-Ментен в обратных координатах называют графиком Лайнуивера-Берка (рис. 6.2). Используя его, величину KM можно определить либо по наклону прямой и длине отрезка, отсекаемого на оси у, либо по длине отрезка, отсекаемого в области отрицательных значений на оси х. Поскольку [S] измеряют в молях/литр, KM имеет ту же размерность. Скорость V0 может быть выражена в любых единицах, поскольку KM не зависит от [E]. График Лайнуивера-Берка позволяет определять KM по относительно небольшому числу точек, поэтому он часто используется для расчета этого параметра.
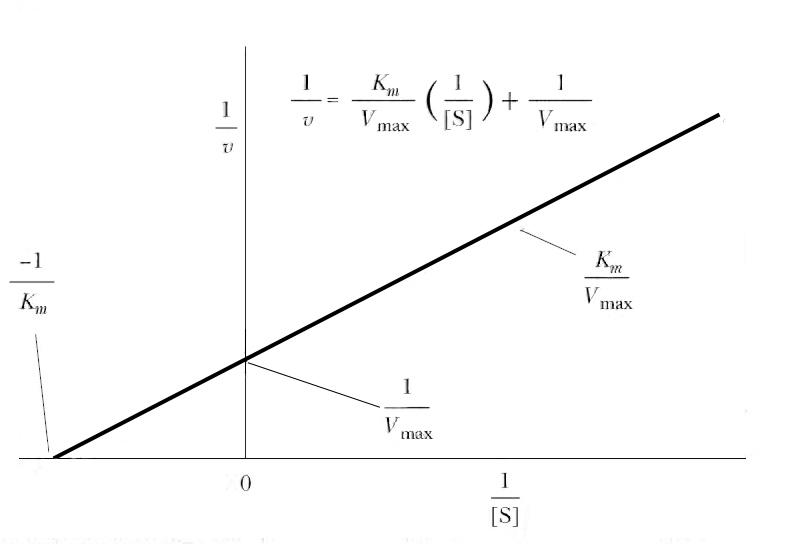
Рис. 6.2 |
График Лайнуивера-Берка в двойных обратных координатах (зависимость 1/V0 от 1/[S]), используемый для графического определения KM и Vmax. |
Используя график Лайнуивера-Берка на практике, при определении KM, иногда сталкиваются с тем, что почти все точки оказываются в области низких концентраций субстрата. Это происходит в тех случаях, когда измерения проводят через равные интервалы [S]. Чтобы этого избежать, измерения следует проводить при таких значениях [S], которые соответствуют равным интервалам на оси х в обратных величинах.
Еще одним вариантом линеаризации зависимости скорости ферментативной реакции от концентрации субстрата является преобразование Хейнса-Вулфа. Если в уравнении Михаэлиса-Ментен в обратных координатах
![]()
обе части умножить на величину [S], получим:
![]()
или
![]()
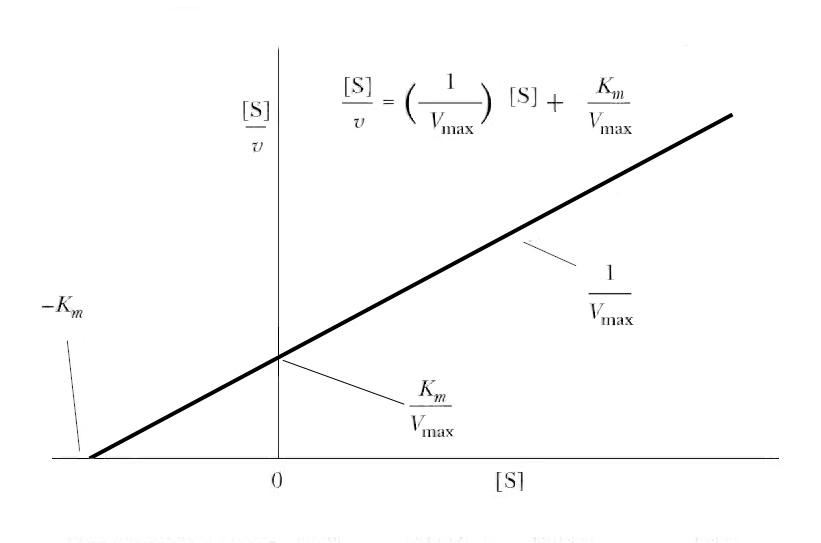
Рис. 6.3 |
График Хейнса-Вулфа в координатах [S]/V0 от [S], используемый для графического определения KM и Vmax. |
График зависимости [S]/V0) от [S] (рис. 6.3) представляет собой прямую линию, где тангенс угла наклона равен величине 1/Vmax, длина отрезка, отсекаемого на оси у, будет равна KM/Vmax, а отрезок, отсекаемый на оси х, равен величине
–KM.
Определение KM имеет большую практическую ценность. При концентрациях субстрата, в 100 раз превышающих KM, фермент будет работать практически с максимальной скоростью, поэтому максимальная скорость, Vmax, будет отражать количество присутствующего активного фермента. Это немаловажное обстоятельство используют для оценки содержания фермента в препарате. Знание величины KM позволяет определить, какое количество субстрата следует внести в реакционную смесь для определения Vmax. Графики, построенные в обратных координатах, находят широкое применение также при анализе характера действия ингибиторов в ферментативных реакциях.
