
- •Часть II
- •Содержание
- •Лабораторная работа № 4
- •Ферменты
- •Отличие ферментов от неорганических катализаторов
- •Номенклатура и классификация ферментов
- •Коферменты
- •Свойства и функции коферментов
- •Специфичность ферментов
- •Изоферменты
- •Сравнительное действие ферментов и катализаторов неорганической природы
- •Лабораторная работа № 5
- •Активный центр фермента
- •Молекулярные механизмы ферментативного катализа
- •Мультисубстратные комплексы
- •Количественное определение ферментативной активности
- •Факторы, влияющие на активность ферментов
- •Регуляция каталитической активности ферментов
- •Регуляция путем изменения биосинтеза ферментов
- •Компартментализация ферментов в клетке
- •Лабораторная работа № 6
- •Кинетика ферментативных реакций
- •Уравнение Михаэлиса-Ментен
- •Графическое определение константы Михаэлиса (Кm)
- •Упростив уравнение, получаем:
- •Ингибирование активности ферментов
- •Конкурентное ингибирование аналогами субстрата
- •Графическая оценка констант конкурентного ингибирования
- •Бесконкурентное ингибирование
Лабораторная работа № 6
Тема: |
Кинетика ферментативных реакций. Ингибиторный анализ
|
Цель работы: |
Определение основных кинетических параметров, ферментативных реакций – константы Михаэлиса и максимальной скорости реакции. Определение характера ингибирующего действия сульфата меди на скорость реакции расщепления крахмала. |
Оборудование и материалы:
Спектрофотометр Solar PV 1251B
Кюветы стеклянные
pH-метр
Мешалка магнитная
Якоря магнитные
Термостат
Пробирки
Штативы для пробирок
Цилиндры мерные на 10 мл и 100 мл
Стаканы стеклянные градуированные на 10 и 100
Колбы на 100-250мл
Стакан на 300 мл
Автоматические микропипетки
палочки стеклянные
Бумага миллиметровая
Реактивы:
Амилаза бактериальная
Крахмал, 0.25% раствор
Ацетилтиохолин йодид
Ацетилхолин бромид
Дитиобиснитробензойная кислота
Бикарбонат натрия
Гуинидин сульфат
Раствор Люголя (йод, 1% раствор в KJ, 2,5%)
Сульфат меди (CuSO4), 2% раствор
Хлорид натрия (NaCl), 1% раствор
Вода дистиллированная
Теоретическое часть
Кинетика ферментативных реакций
Уже в ранних исследованиях по влиянию концентрации реагента на скорость ферментативных реакций была обнаружена очень важная особенность ферментативного катализа, которая заключается в сложном характере кинетики этих реакций. Так, при низких концентрациях реагента (или субстрата) реакция протекает в соответствии с уравнением первого порядка. При высоких концентрациях субстрата скорость перестает зависеть от концентрации и, таким образом, реакция в этих условиях протекает в соответствии с уравнением нулевого порядка. Общий вид зависимости скорости ферментативной реакции от концентрации субстрата при такой двухступенчатой кинетике приведен на рис. 6.1. При высоких концентрациях субстрата весь фермент оказывается связанным с субстратом, и скорость реакции будет максимальной. Другими словами, в реакциях, катализируемых ферментами, стадией, определяющей скорость процесса, будет стадия распада комплекса на фермент и продукт.
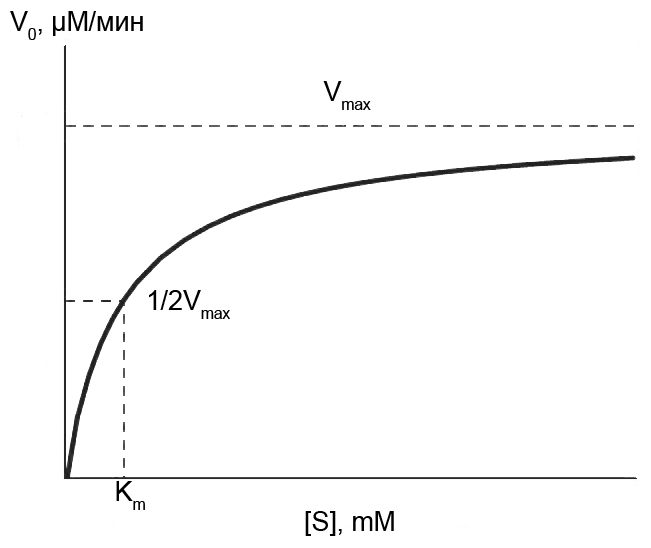
Рис. 6.1 |
Зависимость скорости ферментативной реакции от концентрации субстрата. |
Итак, начальная скорость ферментативной реакции, обозначенная на рис. 6.1 символом V0 (скорость, измеряемая за период, когда израсходована небольшая часть субстрата) увеличивается по мере роста концентрации субстрата в реакционной смеси. При неизменности остальных условий (концентрации фермента [Е], концентрации кофакторов, температуры, значения рН) это увеличение начальной скорости ферментативной реакции, в зависимости от концентрации субстрата происходит до тех пор, пока не наступит состояние насыщения фермента субстратом. Скорость реакции, измеренная в условиях насыщения, уже не зависит от дальнейшего повышения концентрации субстрата. Она достигает максимального значения, называемого максимальной скоростью реакции, Vmax, которая далее остается постоянной.
В ферментативной кинетике обычно используют значительный молярный избыток субстрата по сравнению с концентрацией фермента. Например, если фермент с молекулярной массой 100.000 взаимодействует с субстратом с молекулярной массой 100 и оба компонента присутствуют в реакционной смеси в концентрации 1 мг/мл, каждый, то на один моль фермента будет приходиться 1000 молей субстрата. В клетке наиболее реальными являются следующие численные значения концентраций фермента и субстрата: [E] = 0,1 мкг/мл = 10 – 9 М, [S] = 0,1 мг/мл = 10 – 3 М, т.е. молярный избыток субстрата по отношению к ферменту составляет величину, равную 106. Даже при уменьшении [S] в 100 раз, его концентрация все еще будет 10.000-кратно превышать концентрацию фермента.
