
- •Часть II
- •Содержание
- •Лабораторная работа № 4
- •Ферменты
- •Отличие ферментов от неорганических катализаторов
- •Номенклатура и классификация ферментов
- •Коферменты
- •Свойства и функции коферментов
- •Специфичность ферментов
- •Изоферменты
- •Сравнительное действие ферментов и катализаторов неорганической природы
- •Лабораторная работа № 5
- •Активный центр фермента
- •Молекулярные механизмы ферментативного катализа
- •Мультисубстратные комплексы
- •Количественное определение ферментативной активности
- •Факторы, влияющие на активность ферментов
- •Регуляция каталитической активности ферментов
- •Регуляция путем изменения биосинтеза ферментов
- •Компартментализация ферментов в клетке
- •Лабораторная работа № 6
- •Кинетика ферментативных реакций
- •Уравнение Михаэлиса-Ментен
- •Графическое определение константы Михаэлиса (Кm)
- •Упростив уравнение, получаем:
- •Ингибирование активности ферментов
- •Конкурентное ингибирование аналогами субстрата
- •Графическая оценка констант конкурентного ингибирования
- •Бесконкурентное ингибирование
Регуляция каталитической активности ферментов
Важнейшую роль в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов конкретного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма. Различают регуляцию путём ковалентной и нековалентной модификации.
Регуляция путём ковалентной модификации
Частичный (ограниченный) протеолиз
Некоторые ферменты первоначально синтезируются в клетке в неактивной форме и, после секретирования из клетки в полость, переходят в активную форму. Неактивный предшественник фермента называется проферментом, или зимогеном. Проферменты неактивны, так как в них не сформирован активный центр: образующие его аминокислотные остатки, присутствуют, но они расположены друг относительно друга не должным образом.
Активация профермента заключается в формировании активного центра фермента, которое происходит в результате отщепления участка полипептидной цепи, что приводит к изменению первичной структуры белка с одновременным изменением его трехмерной структуры.
Синтез в форме неактивных проферментов, является характерным свойством пищеварительных ферментов, белковых гормонов (проинсулин–инсулин), фибриллярного белка соединительной ткани коллагена, а также ферментов системы свертывания крови и фибринолиза (протромбин– тромбин).
Например, активация химотрипсиногена осуществляется под действием трипсина, расщепляющего пептидную связь между аргинином-15 и изолейцином-16. Образующийся при этом активный -химотрипсин действует на другие молекулы химотрипсиногена (рис. 5.8).
Далее -химотрипсин подвергается дополнительному протеолитическому действию химотрипсина с выщеплением двух дипептидов Ser14—Arg15 и Thr147—Asn148 и образованием стабильной формы фермента – -химотрипсина.
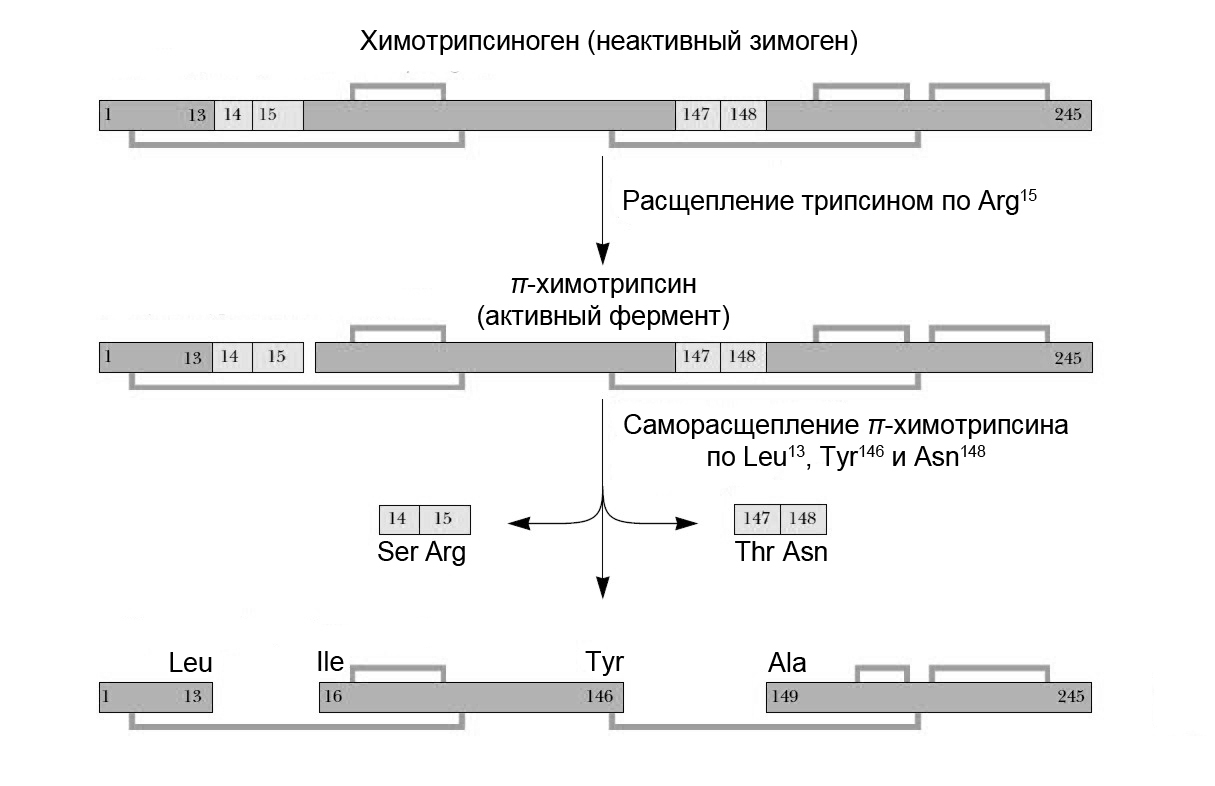
Рис. 5.8. |
Схема протеолитической активации химотрипсиногена. |
В результате изменения первичной структуры в молекуле химотрипсиногена возникают новые нековалентные связи, изменяется конформация полипептидной цепи и формируется активный центр за счет сближения принципиально важных для катализа аминокислотных остатков Ser195, His57 и Asp102 (рис. 5.9).
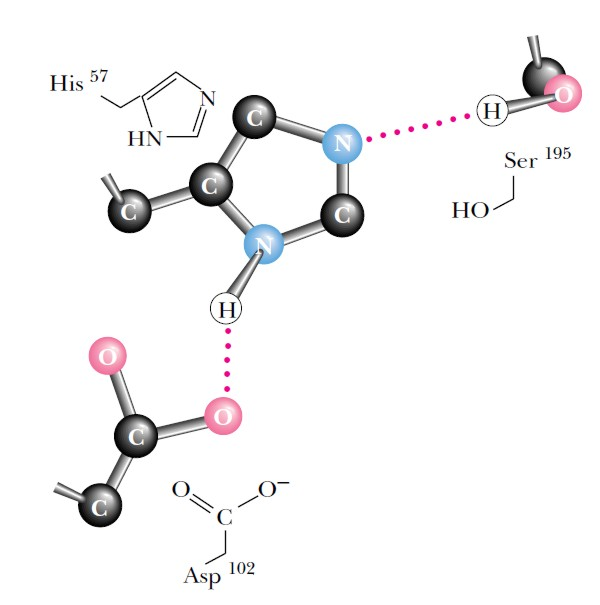
Рис. 5.9. |
Взаимное расположение остатков Ser195, His57 и Asp102, формирующих, так называемую систему переноса заряда в активном центре химотрипсина. |
Физиологический смысл продукции пищеварительных ферментов в форме проферментов, заключенных в зимогеновые гранулы состоит в том, что в противном случае эти чрезвычайно активные гидролазы оказывали бы мощный деструктивный эффект на клеточные белки слизистой желудка и поджелудочной железы, вызывая разрушение этих клеток. Такое разрушение клеток может наблюдаться, например, при панкреатите, когда активация химотрипсина происходит непосредственно в поджелудочной железе.
Белок-белковые взаимодействия
Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Различают 2 механизма активации ферментов указанным путём:
активация ферментов в результате присоединения регуляторных белков
Активность некоторых ферментов регулируется специальными белками. Например, белок кальмодулин после связывания ионов кальция приобретает свойства фермента и приобретает способность активировать фосфодиэстеразу, киназу лёгких цепей миозина. Фермент плазматической мембраны клетки аденилатциклаза активируется путём присоединения одной из субъединиц G-белка, в результате чего происходит реакция образования из АТР циклического 3',5'-АМР (вторичного внутриклеточного посредника действия гормонов).
изменение каталитической активности фермента вследствие ассоциации и диссоциации его протомеров
Некоторые ферменты-олигомеры могут изменять свою активность за счет ассоциации / диссоциации протомеров, входящих в их состав. Например, фермент протеинкиназа является олигомером, состоящим из 4 протомеров двух типов: каталитического и регуляторного. В одном протомере находится активный центр, в другом – регуляторный, который может связываться с сАМР. В ассоциированном виде фермент неактивен, так как его активный центр закрыт регуляторной субъединицей. В диссоциированном состоянии активный центр открывается и может реагировать с субстратом. Когда в клетке образуется необходимое количество сАМР, его связывание с регуляторным центром вызывает диссоциацию фермента на субъединицы, что приводит к его активации. При уменьшении концентрации сАМР он покидает регуляторный центр, что приводит к объединению субъединиц (ассоциации) и инактивации фермента.
Фосфорилирование – дефосфорилирование
Данный способ регулирования активности (принцип «включено / выключено») основан на изменении структуры фермента за счет присоединения фосфатной группы. Некоторые ферменты, присоединяя (процесс фосфорилирования) или отщепляя (процесс дефосфорилирования) остаток фосфорной кислоты, могут изменять свою активность (рис. 5.10). Фосфорилирование ферментов в клетке происходит с участием протеинкиназы. Остаток фосфорной кислоты чаще всего связывается с боковой группой остатков серина или треонина. Если в клетке активна фосфопротеинфосфатаза, – протекает противоположный процесс (дефосфорилирование).
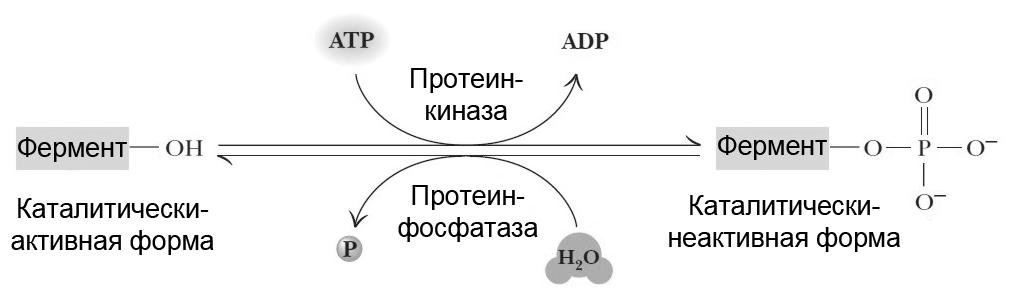
Рис. 5.10. |
Ковалентная модификация ферментов, осуществляемая путём фосфорилирования / дефосфорилирования. |
Активность протеинкиназ и фосфопротеинфосфатаз находится под гормональным контролем и регулируется также нервной системой.
В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Например, активность ферментов гликогенсинтазы (фермент биосинтеза гликогена) и гликогенфосфорилазы (фермент распада гликогена) регулируется путем фосфорилирования / дефосфорилирования. Природа данных ферментов такова, что фосфорилированная форма гликогенфосфорилазы активна, а гликогенсинтазы – неактивна. При дефосфорилировании их активности меняются на противоположные. Биологический смысл заключается в том, что когда происходит биосинтез гликогена, его распад ингибируется, и наоборот.
Регуляция путём нековалентной модификации
Аллостерическая регуляция
В состав ряда ферментов кроме активного центра входит специфический центр – аллостерический, предназначенный для связывания особых низкомолекулярных веществ, способных изменять активность таких ферментов. Аллостерический (или регуляторный) центр представляет собой участок молекулы фермента, с которым связываются низкомолекулярные соединения называемые аллостерическими эффекторами, играющими роль активаторов или ингибиторов. Структура эффекторов отлична от структуры субстрата. Связываясь с аллостерическим центром, эффекторы индуцируют изменения третичной и/или четвертичной структуры молекулы фермента и соответственно структуры активного центра, вызывая увеличение или уменьшение его активности. Таким образом, связывание эффектора в одном участке фермента вызывает изменение структуры в другом участке и, следовательно, приводит к изменению активности фермента в целом. Это явление лежит в основе, так называемой, аллостерической регуляции активности ферментов. Ферменты, активность которых регулируется соединениями, связывающимися в аллостерическом центре, называются аллостерическими.
Как правило, аллостерические ферменты катализируют ключевые реакции метаболических путей, что позволяет клетке чрезвычайно быстро реагировать на малейшие изменения внутреннего состояния. Обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение. Аллостерические ферменты обладают свойством кооперативности: взаимодействие эффектора с аллостерическим центром вызывает последовательное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
Аллостерическая регуляция имеет большое значение в следующих ситуациях:
при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
при катаболических процессах. В случае накопления АТР в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
для координации анаболических и катаболических путей. АТР и АDP – аллостерические эффекторы, действующие как антагонисты;
для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
