
- •5.Методи синтезу алканів
- •6. Хімічні властивості алканів.
- •7.Будова молекули етилен, sp2-гібридизація атому вуглецю..
- •8.Методи одержання алкенів.
- •9.Поняття про механізми хімічних перетворень алкенів.
- •10.Реакції приєднання алкенів.
- •11.Реакції окиснення, полімеризації та ізомеризації.
- •12. Хімічні властивості бензену.
- •13.Реакції ароматичного електрофільного заміщення.
- •14. Взаємний вплив атомів в молекулі толуену.Хімічні властивості толуену.
- •15.Способи утворення зв”язку с─Hal
- •17.Способи утворення спиртової гідроксогрупи.
- •22. Етери.Добування хімічні властивості.
- •18.Хімічні властивості одноатомних насичених спиртів.
- •20.Гліцерол, способи його одержання та хімічні властивості.
- •21.Хімічні властивості фенолу.
- •24 Хімічні властивості одноосновних насичених кислот.
- •25.Властивості аліфатичних амінів.
- •26. Методи синтезу α- та β-амінокислот
- •2. Класифікація реакцій за їх наслідком.
- •16.Хімічні властивості моногалогеналканів.
- •19.Гліколі,способи одержання та властивості.
- •4.Будова σ-зв”язку.Sp3-гібридизація атома вуглецю в орг.Сп.
2. Класифікація реакцій за їх наслідком.
1. Заміщення: R-X + Y => R-Y + X
2. Приєднання:
![]()
3. Відщеплення(елімінування):
![]()
4. Ізомеризація та перегрупування:
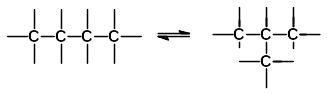
О.Х.
16.Хімічні властивості моногалогеналканів.
Дія нуклеофільних реагентів на електрофільні центри галогеналканів приводить до заміщення атома галогену за схемою:
![]()
Нуклеофіли реагують як аніони або нейтральні молекули,а субстрати як нейтральні сполуки або як катіони.
До нуклеофільних реагентів належать аніони(CR3-, NH2-, HO-, Hal-, RCOO-, RO-, RS-, ArO-, NO2-, CN- тощо) або сполуки з неподіленою парою електронів(NH3, NH2OH, NR3, H2O, ROH, ROR, RSH, NaHSO3 тощо)
Заміна одного галогену іншим(реакція Фінкельштейна):
![]()
Утворення етерів(реакція О.Вільямсона):
![]()
Утворення естерів:
![]()
Утворення амінів(реакція Гофмана):
![]()
Утворення амінів(реакція З.Габріеля):
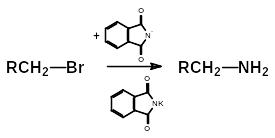
Утворення нітрилів(реакція Кольбе):
![]()
Реакції заміщення галогену воднем є відновленням галогеналканів під дією HI, каталітично збудженого або атомарного водню (Na+NH3). Для відновлення застосовують також тетрагідроалюмінат літію та тетрагідроборат натрію.
Реакції галогеналканів з металами проходить по різному взалежності від умов:
СH3Br + Na => CH3-Na + NaBr
CH3Br + Na => C2H6 + 2NaBr,
Можливе утворення реактивів Гріньяра:
СH3Br + Mg => CH3-MgBr
Реакції відщеплення(бувають мономолекулярні Е1 та Бімолекулярні Е2)
О.Х.
19.Гліколі,способи одержання та властивості.
Гліколі – двоатомні насичені спирти або алкандіоли, загальною формулою СnНn(OH)2. Назву утворюють додаванням до назви алкану закінчення –діол з позначенням місця ОН-груп у головному ланцюгу.
Одержання : 1)гідроліз дигалогенопохідних або галогеногідринів
![]()
2)гідратація органічних оксидів
![]()
3)окиснення алкенів водними розчинами KMnO4, H2O2.
![]()
4)відновлення естарів дикарбонових кислот за методом Буво-Блана.
![]()
5)відновлення кетонів за допомогою Na, Zn, Mg або електрохімічне відновлення
![]()
Гліколіз це високов’язкі рідини або кристалічні речовини з солодким смаком,із зростанням кількості ОН-груп солодкий смак посилюється.
Властивості: 1)кислотні властивості зумовлені наявністю другої ОН-групи
![]()
2)утворення етерів і естерів:
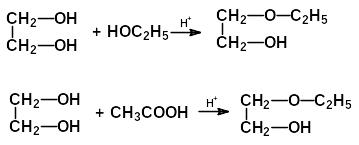
3)реакції дегідратації для спиртів можливі як внутрішньо молекулярні так і міжмолекулярні, також сюда відносять реакцію пінаколінового перегрупування.
4)окиснення гліколів:
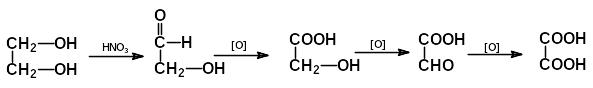
О.Х.
4.Будова σ-зв”язку.Sp3-гібридизація атома вуглецю в орг.Сп.
при збудженні атома вуглецю під дією тепла або опромінення відбуваєтьсі перехід одного електрона з нижнього підрівня на вищій (з s-підрівня на р). залишкова s-орбіталь зміщується або гібридизується з трьому іншими р-орбіталями з утворенням чотирьох однагових sp3-гібридних орбіталей. Гібридна sp3-орбіталь за формою нагадує витягнутий деформований еліпс. Між собою вини утворюють кут 109˚28΄ і є орієнтовані до вершини тетраедра, що з їх максимальним віддаленям одна від одної внаслідок взаємного електростатичного відштовхування. У процессі перекривання sp3-орбіталей з іншими орбіталями утворюється міцніші напрямлені до вершини тетраедра ковалентні σ-зв”язки, внаслідок чого загальна енергія молекули зменшується. Подібне перкривання називається осьовим.
Таким чином, σ-зв”язок─ зв”язок, утворений перекриванням s-, р- і гібридних орбіталей вздовж осі, що з”єднує ядра двох атомів. σ-зв”язок має одну ділянку перекривання орбіталей, завжди одинарний. Стан sp3-гібридизації характерний для алканів.
