
- •5.Методи синтезу алканів
- •6. Хімічні властивості алканів.
- •7.Будова молекули етилен, sp2-гібридизація атому вуглецю..
- •8.Методи одержання алкенів.
- •9.Поняття про механізми хімічних перетворень алкенів.
- •10.Реакції приєднання алкенів.
- •11.Реакції окиснення, полімеризації та ізомеризації.
- •12. Хімічні властивості бензену.
- •13.Реакції ароматичного електрофільного заміщення.
- •14. Взаємний вплив атомів в молекулі толуену.Хімічні властивості толуену.
- •15.Способи утворення зв”язку с─Hal
- •17.Способи утворення спиртової гідроксогрупи.
- •22. Етери.Добування хімічні властивості.
- •18.Хімічні властивості одноатомних насичених спиртів.
- •20.Гліцерол, способи його одержання та хімічні властивості.
- •21.Хімічні властивості фенолу.
- •24 Хімічні властивості одноосновних насичених кислот.
- •25.Властивості аліфатичних амінів.
- •26. Методи синтезу α- та β-амінокислот
- •2. Класифікація реакцій за їх наслідком.
- •16.Хімічні властивості моногалогеналканів.
- •19.Гліколі,способи одержання та властивості.
- •4.Будова σ-зв”язку.Sp3-гібридизація атома вуглецю в орг.Сп.
25.Властивості аліфатичних амінів.
Алкіламіни─це рідини або гази. Середні аміни меє неприємний запах, вищі аміни запаху не мають. Температура кіпіння або плавлення первинних амінів вища ніж вторинних або третинних, для сполук з однаковою молекулярною массою. Це пояснюється існуванням водневих зв”язків.
Хімічні властивості: хімічні властивості амінів визначаються аміногрупою, азот якої містить пару неподілених електронів. Тому для амінів у першу чергу характерні основні властивості і нуклеофільна реакційна здатність.
водні розчини амінів мають лужну реакцію:
R─NH2+HOH R─N+H3+OH─
Реакцією амінів з мінеральними кислотами одержують відповідні солі амонію: R─NH2+HCl => R─NH3+·Cl─
хлористий алкіл амоній
У неводних розчинах сила основності амінів зростає від первинних до третинних. Але у водних розчинах основність третинних амінів знижується порівняно з вторинними.
реакції алкілювання (реакція Гофмана):
R─CH2─NH2+R─CH2─Br => (RCH2)2NH+HBr
(RCH2)2NH+ R─CH2─Br => (RCH2)3N+HBr
(RCH2)3N+ R─CH2─Br => (RCH2)4N+Br─
р
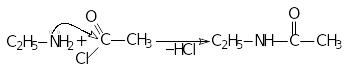 еакції
ацилювання:
еакції
ацилювання:
δ─
δ+
третинні аміни не ацилюються.
взаємодія з нітритною кислотою.
Первинні аміни утворюють спирти:
R─NH2+HNO2 => R─OH+N2+H2O
Вторинні аміни утворюють нітрозоаміни:
СH3─NH─CH3+HO─NO => CH3─NСН3─N=O+H2O
Третинні аміни при кімнатній температурі з нітритною кислотою не взаємодіють.
О.Х.
26. Методи синтезу α- та β-амінокислот
1.Гідроліз білкових речовин. Гідролізом білків у присутності кислот утворюються складні суміші, які містять 20 різних амінокислот і які потім розділяють на індивідуальні.
2.Мікробіологічний синтез заснований на збатності деяких мікроорганізмів виробляти певні амінокислоти. У такий спосіб у промисловості з поживного середовища (меляси, білкових гідролізатів) добувають кормовий концентрат лізину (2,6-діаміногексанової кислоти).
3.Одержання з галогенозаміщених кислот (Фішер). Даний метод застосовується для синтезу α-амінокислот:
![]()
4.Одержання з ціангідринів (α-гідроксинітрилів):
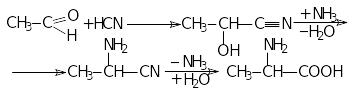
5.Одержання з ціанангідридів (метод Зелінського):
 δ+
δ─
δ+
δ─
альдімін
6![]() .Амінавання
α-кетокислот
у присутності паладію.
.Амінавання
α-кетокислот
у присутності паладію.
7.Приєднання аміаку до насичених α-, β-кислот.
![]()
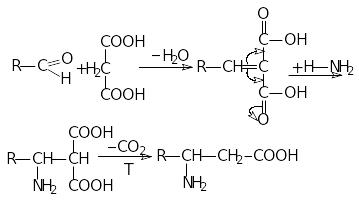
8.Одержання з малонової кислоти:
![]()
![]()
О.Х.
27.Хімічні властивості амінокислот.
у![]() водних розчинах форма існування
амінокислот залежить від рН середовища
у вигляді рівноважних форм:
водних розчинах форма існування
амінокислот залежить від рН середовища
у вигляді рівноважних форм:
рН>7 рН<7
аніонна форма цвітер-іон катіонна форма
значення рН розчину, при якому концентрація цвітер-іонів максимальна називається ізоелектричною точкою.
у хімічному відношенні амінокислоти проявляють практично всі властивості аміну і карб.кислоти.
1.реакції за аміногрупою.
-![]() алкілювання
алкілювання
гліцин N-метилгліцин
при подальшому алкілюванні утворюються третинні алкілпохідні, а також четвертинні амонійні основи, внутрішні солі, які наз.бетаїни.
-![]() ацилювання:
ацилювання:
![]()
-![]() при
дії нітритної кислоти АК перетворюються
у відповідні гідроксикислоти:
при
дії нітритної кислоти АК перетворюються
у відповідні гідроксикислоти:
2.реакції за карбоксильною групою.
-![]() утворення
галогенангідридів:
утворення
галогенангідридів:
-![]() утворення
естерів:
утворення
естерів:
-![]() декарбоксилювання:
декарбоксилювання:
3.утворення комплексних сполук з важкими металами
глікоколят купруму
4.реакції, що розрізняють α-,β-,γ-амінокислоти:
п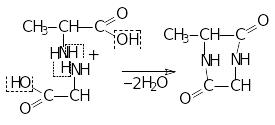 о
відношенню АК до нагрівання можна
зробити висновок про місце знаходження
аміно групи
о
відношенню АК до нагрівання можна
зробити висновок про місце знаходження
аміно групи
α-амінокислоти:
Диметилдикетопіперазин
β![]() -амінокислоти:
-амінокислоти:
γ-амінокислоти:
О.Х.
1.Номенклатура в о.х.,як засіб позначення хім-х сполук. Відомі три основні різновиди номенклатур для органічних сполук: 1)тривіальна, 2)раціональна, 3)систематична, або міжнародна(IUPAC).
Тривіальні, або емпіричні назви органічних сполук були першими, які давалися речовинам згідно з: 1)природними джерелами одержання; 2)методами одержання;3)ім’ям першовідкривача.
Номенклатура IUPAC допускає декілька варіантів утворення назв органічних сполук,з яких найуживанішими є замісників і радикально-функціональний варіанти.
Послідовність складання назви, для замісникової IUPAC включає: 1)визначення головної(старшої) групи, 2)вибір родоначальної структури, 3)нумерація родоначальної структури, 4)послідовність складання назви в загальному вигляді: Назва = префікс+корінь+суфікс.
О.Х.
