
- •5.Методи синтезу алканів
- •6. Хімічні властивості алканів.
- •7.Будова молекули етилен, sp2-гібридизація атому вуглецю..
- •8.Методи одержання алкенів.
- •9.Поняття про механізми хімічних перетворень алкенів.
- •10.Реакції приєднання алкенів.
- •11.Реакції окиснення, полімеризації та ізомеризації.
- •12. Хімічні властивості бензену.
- •13.Реакції ароматичного електрофільного заміщення.
- •14. Взаємний вплив атомів в молекулі толуену.Хімічні властивості толуену.
- •15.Способи утворення зв”язку с─Hal
- •17.Способи утворення спиртової гідроксогрупи.
- •22. Етери.Добування хімічні властивості.
- •18.Хімічні властивості одноатомних насичених спиртів.
- •20.Гліцерол, способи його одержання та хімічні властивості.
- •21.Хімічні властивості фенолу.
- •24 Хімічні властивості одноосновних насичених кислот.
- •25.Властивості аліфатичних амінів.
- •26. Методи синтезу α- та β-амінокислот
- •2. Класифікація реакцій за їх наслідком.
- •16.Хімічні властивості моногалогеналканів.
- •19.Гліколі,способи одержання та властивості.
- •4.Будова σ-зв”язку.Sp3-гібридизація атома вуглецю в орг.Сп.
20.Гліцерол, способи його одержання та хімічні властивості.
Г![]() ліцерол─
триатомний насичений спирт СН2ОН─СН(ОН)─СН2ОН
ліцерол─
триатомний насичений спирт СН2ОН─СН(ОН)─СН2ОН
Методи одержання:
г
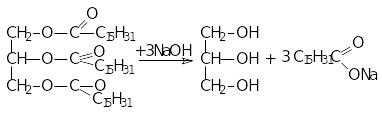 ідроліз
рослинних і тваринних жирів:
ідроліз
рослинних і тваринних жирів:
синтез з пропілену:
![]()
Хімічні властивості:
1![]() .
кислотні властивості.
.
кислотні властивості.
2![]() .
утворення естерів:
.
утворення естерів:
3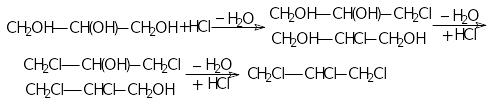 .
утворення галогеногідринів:
.
утворення галогеногідринів:
4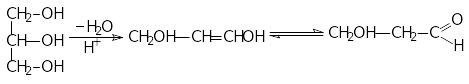 .
дегідратація:
.
дегідратація:
![]()
О.Х.
23. Способи утворення карбонільної групи.
1. Окиснення спиртів: R─CH2─OH+[O] R─COH
R─CH(OH)─R’+[O] => R─CO─R’
2.Дегідрування спиртів (t>150ºС kat─Cu):
R─CH(OH)─R’ => R─CO─R’
3.Відновлення карб.кислот:
R─COOH+H2 => R─COH+H2O
4.Гідроліз геиінальних дигалогенпохідних:
![]()
5.суха перегонка Са-євих солей одноосновних карб.кислот:
(СН3СОО)2Са => СН3СОН+СаСО3
6.За допомогою металорганічних сполук:
![]()
7.Гідроліз вінілових етерів:
CH2=CH─O─R+HOH => CH3─CH(OH)2 => CH3COH+H2O
За допомогою оксосинтезу:
СН2=СН2+СО+Н2 => СН3─СН2─СОН
(кат─Со(СО)4)
О.Х.
21.Хімічні властивості фенолу.
1.Внаслідок відтягуванняелектронної густини в результаті чого молекула фенолу дисоціює як кислота, фенол проявляє сильніші кислотні властивості ніж насичені спирти, він взаємодіє з лужними металами і розчинами лугів.
Так як гідроксогрупа є замісником першого роду, то при при електрофільному замішенні (галагенування, нітруваннясульфування,алкілювання,ацилювання) заміщуються водні в о- і п-положенні, навідміну від інших похідних аренів для фенола при електрофільному замішенні утворюється більше о- ніж п- похідних.
2.Реакції нуклеофільного заміщення для фенолів не характерні, так галогеноводні зовсім не заміщують гідроксокрупу.Але при дії РСІ3 можливе незначне утворення хлорбензолу: С6Н5ОН+РСІ3 => (С6Н5О)3Р >>+ С6Н5СІ
3![]() .Каталітичне
гідрування:
.Каталітичне
гідрування:
4.Реакції окиснення. Феноли нестійкі до окиснення і залежно від природи окисника та умов реакції дають різні сполуки:
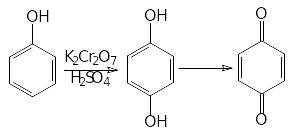
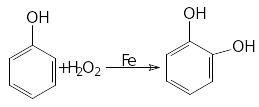
[O]
або
5.Утворення фенолоформальдегідних смол:
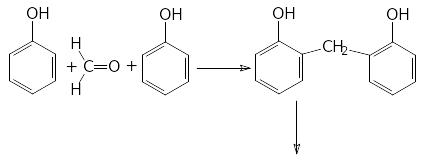
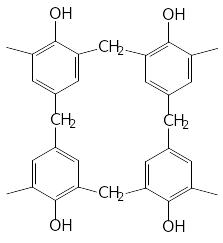
О.Х.
24 Хімічні властивості одноосновних насичених кислот.
1![]() .Кислотні
властивості. Сила карб.кислот залежить
від природи за місника R
біля гідроксильної групи. Взаємодіють
з лужними металами, їх оксидами, лугами,
карбонатами, утворюючи відповідні солі
карб.кислот:
.Кислотні
властивості. Сила карб.кислот залежить
від природи за місника R
біля гідроксильної групи. Взаємодіють
з лужними металами, їх оксидами, лугами,
карбонатами, утворюючи відповідні солі
карб.кислот:
2![]() .Утворення
галогенангідридів (при дії PBr5,
SOCl2,
PCl5,
PCl3):
.Утворення
галогенангідридів (при дії PBr5,
SOCl2,
PCl5,
PCl3):
хлорангідриди є хорошими ацилюючими агентами.
3![]() .Утворення
естерів.
.Утворення
естерів.
4.Утворення амідів. Аміди одержуються при взаємодії кислоти з аміаком через стадію амонійної солі, яку необхідно нагрівати за умов сухої перегонки:
![]()
5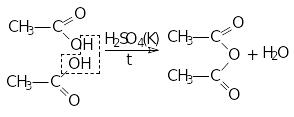 .Утворення
ангідридів: ацетамід
.Утворення
ангідридів: ацетамід
6.окиснення і відновлення:
к![]() арб.кислоти
лінійної будови окислюються важко, за
винятком мурашиної кислоти, яка є
одночасно і альдегідом:
арб.кислоти
лінійної будови окислюються важко, за
винятком мурашиної кислоти, яка є
одночасно і альдегідом:
к![]() ислоти,які
містять у молекулі третинний атом
вуглецю, при окисненні утворюють
відповідні гідроксикислоти:
ислоти,які
містять у молекулі третинний атом
вуглецю, при окисненні утворюють
відповідні гідроксикислоти:
α-гідроксиізобутиратна к-та
П![]() ри
застосуванні іншого окисника─ оксиду
селену отримують α-кетокислоти:
ри
застосуванні іншого окисника─ оксиду
селену отримують α-кетокислоти:
7.Декарбоксилювання карб.кислот:
монокарбонові кислоти термічно стійкі, але при введені в α-положення акцепторних груп їх термічна стійкість зменшується:
СН3─СООН+РОСІ3 => СН2СІСООН = t > СН3СІ+СО2
О.Х.
