
- •5.Методи синтезу алканів
- •6. Хімічні властивості алканів.
- •7.Будова молекули етилен, sp2-гібридизація атому вуглецю..
- •8.Методи одержання алкенів.
- •9.Поняття про механізми хімічних перетворень алкенів.
- •10.Реакції приєднання алкенів.
- •11.Реакції окиснення, полімеризації та ізомеризації.
- •12. Хімічні властивості бензену.
- •13.Реакції ароматичного електрофільного заміщення.
- •14. Взаємний вплив атомів в молекулі толуену.Хімічні властивості толуену.
- •15.Способи утворення зв”язку с─Hal
- •17.Способи утворення спиртової гідроксогрупи.
- •22. Етери.Добування хімічні властивості.
- •18.Хімічні властивості одноатомних насичених спиртів.
- •20.Гліцерол, способи його одержання та хімічні властивості.
- •21.Хімічні властивості фенолу.
- •24 Хімічні властивості одноосновних насичених кислот.
- •25.Властивості аліфатичних амінів.
- •26. Методи синтезу α- та β-амінокислот
- •2. Класифікація реакцій за їх наслідком.
- •16.Хімічні властивості моногалогеналканів.
- •19.Гліколі,способи одержання та властивості.
- •4.Будова σ-зв”язку.Sp3-гібридизація атома вуглецю в орг.Сп.
17.Способи утворення спиртової гідроксогрупи.
1.гідратація алкенів. СН2=СН2+НОН => СН3─СН2─ОН
в присутності мінеральних кислот, найчастіше сульфатної, відбувається за правилом Марковнікова: водень приєднується до найбільш гідрогенізованого атома вуглецю.
2![]() .гідрування
карбонільних сполук:
.гідрування
карбонільних сполук:
3.оксосинтез (карбонілювання водню):
C O+2H2 => CH3OH; 6CO+12H2 => CH3─CH─CH3 +
+ C3H7OH + H2O OH
Дані реакції проходять в присутності каталізаторів (ZnO, Co та ін.) та при підвищенній температурі.
4.окиснення алканів. Нижчі алкани до спиртів не окислюються. Реакція окиснення має практичне застосування для вищіх парафінів (С12─С20):
R─H O2=> R─OH
5.ферментативна переробка вуглеводів:
С6Н12О6 => 2С2Н5ОН+2СО2
6.гідроліз галогенів: R─Hal+H2O => R─OH+HHal
7![]() .синтез
за допомогою реактива Гріньяра:
.синтез
за допомогою реактива Гріньяра:
![]()
Первинні спирти утворюються при дії на мурашиний альдегід, вторинні при дії на всі інші альдегіди і третинні─ при дії на кетони.
О.Х.
22. Етери.Добування хімічні властивості.
Методи одержання:
1![]() .
Дегідратація спиртів:
.
Дегідратація спиртів:
2. Одержання з галогеналкілів (реакція Вільямсона):
C2H5ONa+J─CH2CH3 => C2H5─O─C2H5 ─ NaJ
3. Приєднання спиртів до алкенів:
![]()
4. приєднання спиртів до алкінів:
![]()
Хімічні властивості:
1. утворення оксонієвих сполук. У присутності сильних кислот синтезують протоновані етери (оксонієві сполуки):
СН3─О─СН3+Н+ => СН3─О+ Н ─СН3
2.Розщеплення етерів. А) під дією лужних металів
C2H5─O─C2H5+2Na => C2H5ONa+C2H5Na
Б) під дією кислот:
C2H5─O─C2H5+HJ => C2H5OH+ C2H5J
3. Окиснення. Більшість етерів легко окиснюються приконтакті з киснем повітря, утворюючи пероксидні сполуки. Найлегше окиснення проходить в α-положення відносно атома кисню:
![]()
за умов тривалого зберігання утворюються суміш пероксидних сполук різної будови.
О.Х.
18.Хімічні властивості одноатомних насичених спиртів.
![]() δ─
δ+
δ─
δ+
за рахунок перерозподілу електронної густини молекули одноат.нас.спиртів здатні вступати в реакції заміщення водню гідроксогрупи:
1. в/д з лужними металами
2C2H5OH+2Na => 2C2H5ONa+H2
кислотні властивості спиртів залежать від положення ОН-групи і зменшуються у ряду: первинні > вторинні > тритинні.
2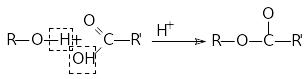 .
реакція естерифікації:
.
реакція естерифікації:
─H2O
C H3CH2OH+HO─NO2
H2SO4
CH3CH2─ONO2+H2O
H3CH2OH+HO─NO2
H2SO4
CH3CH2─ONO2+H2O
Етилнітрат
3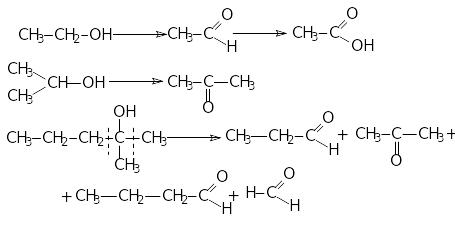 .
окиснення і дегідрогенізація: первинні
спирти утворюють альдегіди, вторинні─кетони,
третинні окислюються важко з розравом
С─С зв”язку.
.
окиснення і дегідрогенізація: первинні
спирти утворюють альдегіди, вторинні─кетони,
третинні окислюються важко з розравом
С─С зв”язку.
[O] [O]
[O]
[O]
дегідрогенізація відбувається в присутності міді. З первинних спиртів утворюються альдегіди, з вторинних ─ кетони.
Реакції розщеплення С-О звязку:
1. заміщення гідрогсильної групи галогеном.
R─CH2OH+PCl5 => R─CH2Cl+POCl3+HCl
2 дегідратація проходить в присутності каталізаторів: H2SO4, H3PO4, P2O5, KHSO4:
R─CH2─CH2─OH => R─CH=CH2+H2O
Відщеплення води від спиртівпідпорядковується правилу Зайцева: приутворенні води водень найлегше відщеплюється від найменш гідрогенізованого атома вуглецю, що знаходиться в β-положенні до ОН-групи.
3.утворення етерів:
CH3OH + H+ CH3O+H2 => CH3 + H2O
+CH3 + HO-CH3 CH3-O+H-CH3 CH3-O-CH3 + H+
диметиловий етер
4.взаємодія із сульфатною к-тою:
CH3-CH2-O-H =H+> CH3-CH2-O+H2 => CH3-C+H2 +
+ H2SO4 =>CH3-CH2-O-SO20H естер-етильсульфат
О.Х.
