
Приложение № 1 мгту им. Н.Э. Баумана
Домашнее задание №2
по ТЕРМОДИНАМИКЕ
«ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ГАЗОВОГО ЦИКЛА»
Группа: Э5-51
Вариант: 29
Студент: Иванов И.И.
Преподаватель: Петров П.П.
Москва 2013 г.
Домашнее задание №2 по курсу «ТЕРМОДИНАМИКА»
«ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ГАЗОВОГО ЦИКЛА»
Дано:
Сухой воздух массой 1 кг совершает прямой термодинамический цикл (Рис. 1), состоящий из четырех последовательных термодинамических процессов, параметры которых определяются преподавателем.
Требуется:
1) рассчитать давление (p), удельный объем (v) и температуру (T) воздуха для основных точек цикла,
2) определить для каждого из процессов значения показателей политропы (n) и теплоемкости (c), вычислить изменение внутренней энергии (u), энтальпии (h), энтропии (s), теплоту процесса (q), работу процесса (l) и располагаемую работу (l0),
3) определить суммарные количества подведенной (q') и отведенной (q'') теплоты, работу цикла (lц), располагаемую работу цикла (l0ц) и термический к.п.д. цикла (t),
4) построить цикл в координатах:
а) lg v – lg p,
б) v – p, используя предыдущее построение для нахождения трех или четырех промежуточных точек на каждом из процессов,
в) s – Т, нанеся основные точки цикла и составляющие его процессы,
5) для одного из процессов цикла, кроме изотермического, привести схему его графического расчета по тепловой s – T диаграмме, изобразив на схеме линию процесса вспомогательные линии изохорного и изобарного процессов, значения температур в начале и в конце процесса, отрезки, соответствующие изменению энтропии в основном и вспомогательных процессах, площади, соответствующие теплоте процесса, изменению внутренней энергии и энтальпии.
Вариант 29
Дано:
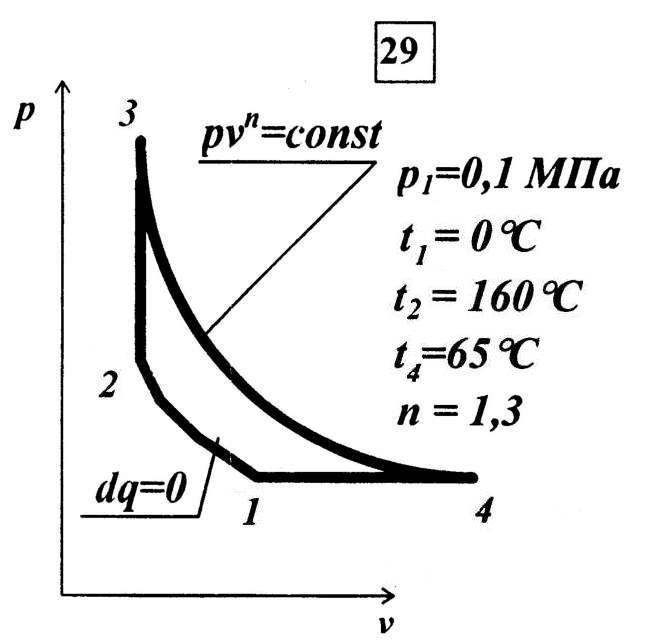
Рис. 1
p1
= 0,1 МПа = 1![]() ;
;
T1 = 273 K; (t1 = 0 0С)
T2 = 433 K; (t2 = 160 0С)
T4 = 338 K; (t4 = 65 0С)
n = 1,3 – показатель политропы
теплоемкости процессов:
cр
= 1,025
![]() ;
;
cv= cр - R =1,025 - 0,287 = 0,738 ;
R = 0,287 ; - газовая постоянная воздуха.
Решение.
1. Определить параметры p, v и T воздуха для основных точек цикла:
а)
для точки 1 дано: p1=0,1
![]() (1
);
T1
= 273 K;
(t1
= 0 0С)
(1
);
T1
= 273 K;
(t1
= 0 0С)
Для определения v1 используем уравнение состояния:
v1
=
![]() ,
,
![]() ;
;
б) для точки 2 дано: T2 = 433 K; (t2 = 160 0С);
– определить p2
и v2.
Для определения v2
используем уравнение адиабаты процесса
1 – 2 в T–v
координатах:
![]() ,
где
,
где
![]() -
показатель адиабаты
-
показатель адиабаты
или
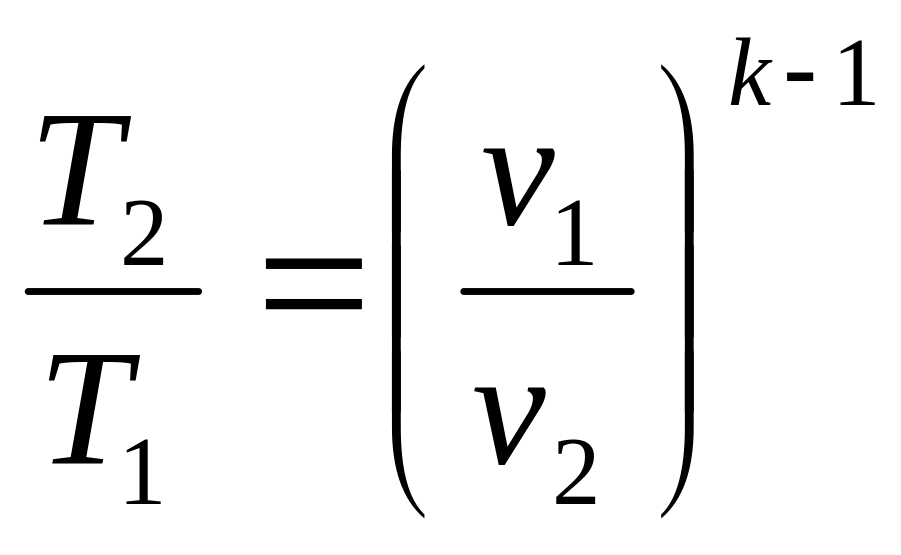
откуда
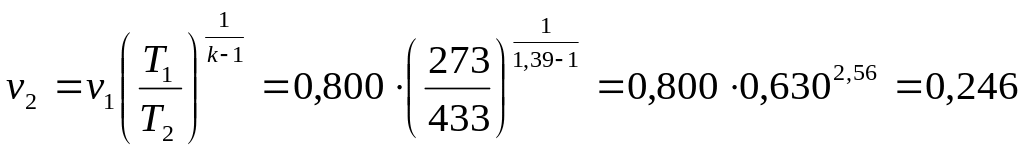 ,
;
,
;
Для определения
p2
используем уравнение состояния: ![]()
откуда
![]() ,
Па
,
Па
в) для точки 4 дано: T4 = 338 K; (t4 = 65 0С); p4 = p1 = 0,1 МПа;
– определить v4.
Для определения v4 используем соотношение параметров изобарного процесса
4 – 1:
![]() ,
, ![]() ,
;
,
;
г) для точки 3 дано: v3 = v2 = 0,246 ;
– определить p3 и T3.
Для определения T3 используем уравнение политропы в T – v координатах при показателе политропы n = 1,3:
![]() или
или
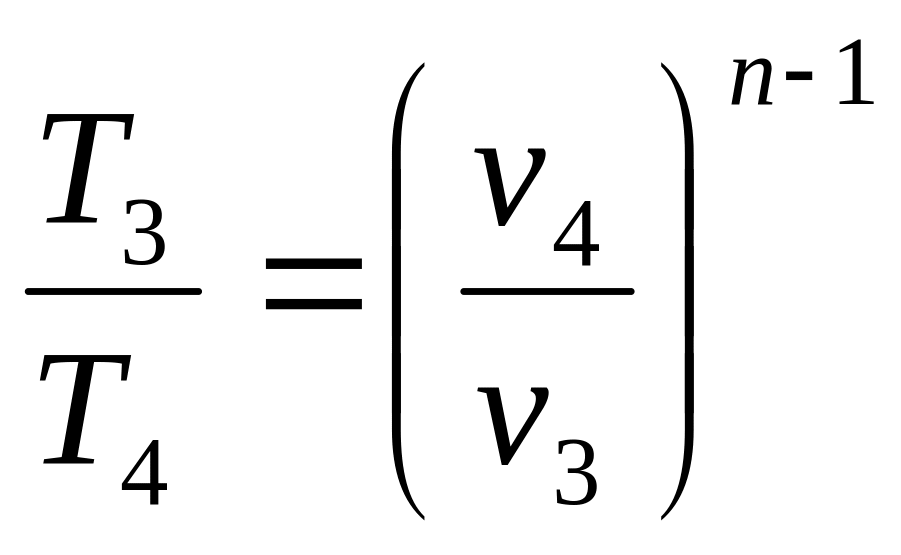
откуда
 ,
K
,
K
Для определения
p3
используем уравнение состояния: ![]()
откуда
![]() ,
Па.
,
Па.
Результаты расчета внести в Таблицу № 1
Таблица № 1
Параметр ® Точка ¯ |
P, бар |
V, м3/кг |
Т, К |
1 |
1,00 |
0,800 |
273 |
2 |
5,05 |
0,246 |
433 |
3 |
5,98 |
0,246 |
513 |
4 |
1,00 |
0,990 |
338 |
2. Для каждого из процессов определить значения показателей политропы (n) и теплоемкости (c), вычислить изменение внутренней энергии (Du), энтальпии (Dh), энтропии (Ds), теплоту процесса (q), работу процесса (l) и располагаемую работу (l0):
a) – процесс 1– 2 – адиабатный:
– определить показателей политропы – для адиабатного процесса:
n =
– определить теплоемкость:
![]() ;
но т. к. dq
= 0, то c
= 0.
;
но т. к. dq
= 0, то c
= 0.
– вычислить изменение внутренней энергии (Du), энтальпии (Dh), энтропии (Ds):
Du2-1 = cv DТ = cv (T2 – T1) = 0,738 (433 – 273) = 118 [кДж/кг]
Dh2-1 = cp DТ = cp (T2 – T1) = 1,025 (433 – 273) = 164 [кДж/кг]
Ds2-1 = 0, т.к. процесс 1– 2 – адиабатный,
q = 0 и теплообмен в нем отсутствует,
– работу процесса и располагаемую работу определить из уравнений первого закона термодинамики:
l1-2 = q1-2 – Du2-1 = – Du2-1 = – 118 [кДж/кг]
l0,1-2 = q1-2 – Dh1-2 = – Dh1-2 = – 164 [кДж/кг]
б) – процесс 2– 3 – изохорный:
– теплоемкость для изохорного процесса равна
с = сv = 0,738 ;
– определить показателей политропы для изохорного процесса:
n = (с – cp)/(с – сv) = (сv – cp)/(сv – сv) = (сv – cp)/0 = ∞,
n = ∞,
– вычислить изменение внутренней энергии (u), энтальпии (h), энтропии (s):
u3-2 = cv Т = cv (T3 – T2) = 0,738 (513 – 433) = 59,0 [кДж/кг]
h3-2 = cp Т = cp (T3 – T2) = 1,025 (513 – 433) = 82 [кДж/кг]
s3-2
= cv
ln Т3/Т2
= 0,738
![]() = 0,125 [кДж/кг
K]
= 0,125 [кДж/кг
K]
– теплоту процесса можно определить по формуле:
q2-3 = c Т = cv (T3 – T2) = u = 59 [кДж/кг]
– где c = cv – теплоемкость газа в рассматриваемом процессе v = const,
– работа в процессе v = const равна нулю, т.е. l2-3 = 0:
l2-3 = p ∆v3-2 = 0
– располагаемую работу процесса определить из уравнений первого закона термодинамики:
так как
l0,2-3 = q2-3 – h3-2 = 59 – 82 = – 23 [кДж/кг]
в) – процесс 3 – 4 – политропный:
– показатель политропы задан: n = 1,3
– теплоемкость для политропного процесса равна
c
= cv(n
– k)/(n
– 1) = 0,738
![]() = – 0,221,
= – 0,221,
– вычислить изменение внутренней энергии (Du), энтальпии (Dh), энтропии (Ds):
Du4-3 = cv DТ = cv (T4 – T3) = 0,738 (338 – 513) = – 129 [кДж/кг]
Dh4-3 = cp DТ = cp (T4 – T3) = 1,025 (338 – 513) = – 179,4 [кДж/кг]
Ds4-3
= cv
ln Т4/Т3
+ R ln v4/v3
= 0,738
![]() = 0,092 [кДж/кг
K]
= 0,092 [кДж/кг
K]
– теплоту процесса можно определить по формуле:
q4-3 = c DТ = c (T4 – T3) = – 0,221(338 – 513) = 38,6 [кДж/кг]
– где c = – 0,221 – теплоемкость газа в рассматриваемом политропном процессе;
– работу в процессе определить из уравнений первого закона термодинамики:
l4-3 = q – Du = 38,6 + 129 = 167,6 [кДж/кг]
– располагаемую работу в процессе определить из уравнений первого закона термодинамики:
l04-3 = q – Dh = 38,6 + 179,4 = 218 [кДж/кг]
г) – процесс 4 – 1 – изобарный:
–теплоемкость для изобарного процесса равна
с = сp = 1,025 ;
– определить показателей политропы для изобарного процесса:
n = (с–cp)/(с–сv) = (сp – cp)/(сp–сv) = 0/(сp–сv) = 0,
n = 0;
– изменение внутренней энергии и энтальпии идеального газа определить по формулам:
Du1-4 = cv DТ = cv (T1 – T4) = 0,738 (273 –338) = – 48 [кДж/кг]
Dh1-4 = cp DТ = cp (T1 – T4) = 1,025 (273 –338) = – 66,6 [кДж/кг]
– изменение энтропии в рассматриваемом процессе определить по одной из следующих формуле:
Ds1-4
= cp
ln Т1/Т4
=
1,025
![]() = – 0,217 [кДж/кг
K]
= – 0,217 [кДж/кг
K]
– теплоту процессов можно определить по формуле:
q4-1 = c DТ = cp (T1 – T4) = Dh1-4 = – 66,6 [кДж/кг]
– где c = cp – теплоемкость газа в рассматриваемом процессе,
– работу процесса и располагаемую работу процесса определить из уравнений первого закона термодинамики:
l1-4 = q4-1 – Du1-4 = – 66,6 + 48 = – 18,6 [кДж/кг]
l01-4 = q4-1 – Dh1-4 = – 66,6 + 66,6 = 0 [кДж/кг]
Все величины, найденные в данном пункте, внести в таблицу 2 с указанием знаков, полученных в расчете.
В таблицу 2 необходимо включить итоговую строчку по вертикальным графам, содержащим величины: Du, Dh, Ds, q, l, l0.
Для величин Du, Dh и Ds суммы должны быть равны нулю, так как u, h и s - функции состояния и, следовательно, за цикл их изменение равно нулю. Суммы q, l и l0 должны быть равны между собой и обязательно положительны (цикл прямой):
åq = ål = ål0 [кДж/кг]
Графы, содержащие показатели процессов и теплоемкости суммированию не подлежат.
Таблица №2
Параметр→ Процесс ↓ |
n |
c, кДж/кг*К |
∆u, кДж/кг |
∆h, кДж/кг |
∆S, кДж/кг*К |
q, кДж/кг |
l, кДж/кг |
l0, кДж/кг |
1–2 |
1,39 |
0,000 |
118 |
164 |
0,000 |
0,000 |
-118 |
-164 |
2–3 |
∞ |
0,738 |
59 |
82 |
0,125 |
59 |
0 |
- 23 |
3–4 |
1,3 |
– 0,221 |
-129 |
-179,4 |
0,092 |
38,6 |
167,6 |
218 |
4–1 |
0 |
1,025 |
- 48 |
- 66,6 |
-0,217 |
-66,6 |
-18,6 |
0 |
Σ |
– |
– |
0,000 |
0,000 |
0,000 |
31,0 |
31,0 |
31,0 |
3. Определить суммарные количества подведенной (q') и отведенной (q'') теплоты, работу цикла (lц), располагаемую работу цикла (l0ц) и термический к.п.д. цикла (ht).
– количество подведенной теплоты:
q' = åqi положит. = q1-2 + q2-3 + q3-4 = 0 + 59 + 38,6 = 97,6 [кДж/кг]
– количество отведенной теплоты:
q" = åqi отрицат. = q4-1 = – 66,6 [кДж/кг]
– количество теплоты, полученное системой за цикл:
qц = åqi = q1-2 + q2-3 + q3-4 + q4-1 = 0 + 59 + 38,6 – 66,6 = 31,0 [кДж/кг]
– определить работу цикла:
lц = åli = l1-2 + l2-3 + l3-4 + l4-1 = –118 + 0 + 167,6 – 18,6 = 31,0 [кДж/кг]
– определить располагаемую работу цикла:
l0ц = ål0i = l0,1-2 + l0,2-3 + l0,3-4 + l0,4-1 = – 164 – 23 + 218 + 0 = 31,0 [кДж/кг]
– определить термический к. п. д. цикла:
ht
= lц/q'
= qц/
q'
= (q'
– |q"|)/q'
=
![]() = 0,317
= 0,317
Полученные данные внести в таблицу №3 или представить в следующем виде:
– количество подведенной теплоты:
q' = 97,6 [кДж/кг]
– количество отведенной теплоты:
q" = – 66,6 [кДж/кг]
– количество теплоты, полученное системой за цикл:
qц = 31,0 [кДж/кг]
– работа за цикл:
lц = 31,0 [кДж/кг]
– располагаемая работа за цикл:
l0ц = 31,0 [кДж/кг]
– термический к. п. д. цикла:
ht = 0,317
4. Построение цикла. Рассматриваемый цикл должен быть построен в масштабе в системе координат: lg v–lg p, v–p и s–Т.
а) в координатах lg v – lg p – цикл представлен на рис. 2. Цикл строится на логарифмической бумаге или в логарифмических координатах при этом не требуется определять логарифмы. При отсутствии логарифмической бумаги построение выполняется на миллиметровой бумаге (в этом случае требуется определять логарифмы). Проследить, чтобы одноименные процессы в координатах lg v–lg p изображались параллельными линиями. Если этого нет, необходимо проверить правильность определения параметров основных точек цикла. Цель данного построения – получить значения p и v в промежуточных точках в политропном, адиабатном и изотермическом процессах, если они есть в цикле, для выполнения следующего пункта.
В данном задании процессы: адиабатный 1– 2 и политропный 3 – 4 изображаются прямыми линиями (рис. 2), поэтому для любого промежуточного давления в этих процессах можно графически определить соответствующий удельный объем.
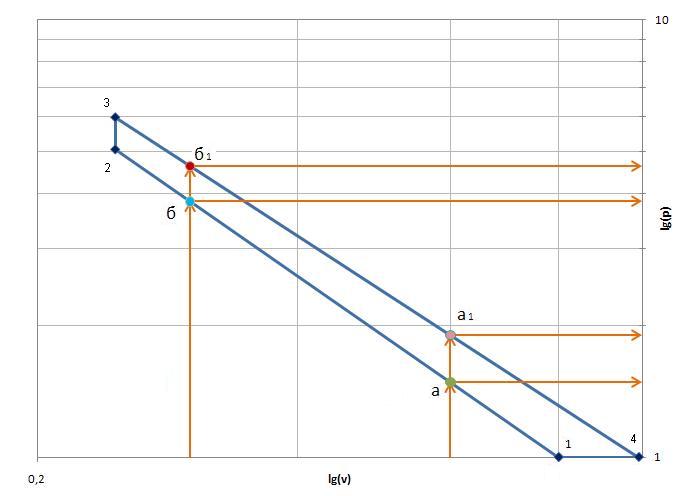
Рис. 2
Значения промежуточных точек сводятся в таблицу № 3:
адиабатный 1– 2, промежуточные точки – а и б
политропный 3 – 4, промежуточные точки – а1 и б1
Таблица № 3
Параметр Точка |
V, м3/кг |
P, бар |
а |
0,6 |
1,48 |
б |
0,3 |
3,85 |
а1 |
0,6 |
1,90 |
б1 |
0,3 |
4,63 |
б) в координатах p–v;
задаться масштабом
![]() в 1
в 1![]() 1
1
![]() в 1
0,02
в 1
0,02
– диаграмма цикла строится в обычной равномерной шкале в координатах v–p для процессов, изображаемых кривыми линиями, строится по данным таблиц №1 и №3, из которых берутся значения p и v для двух–трех промежуточных точек для каждого процесса. Диаграмму рекомендуется строить на листе миллиметровой бумаги, в таком масштабе, чтобы цикл на диаграмме получился размером порядка 100 х 100 мм (Рис. 3).
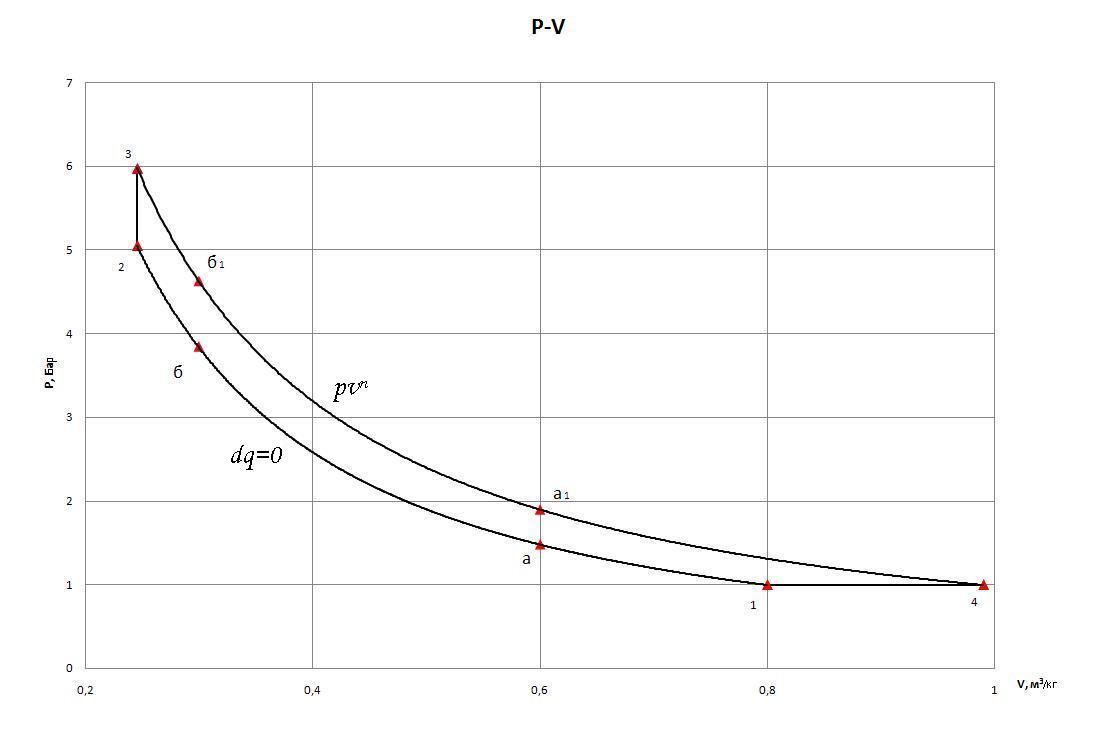
Рис. 3
в)
в координатах
![]() ;
;
задаться масштабом
![]() в 1
20
в 1
20![]() ,
,
![]() в 1
0,016
;
в 1
0,016
;
– для построения диаграммы цикла в координатах s–Т используются параметры, подсчитанные в пунктах 1 (Т) и 2 (s), кривые процессов можно заменить прямыми линиями. На диаграмме должен быть показан порядок построения.
Задается масштаб температуры T и масштаб энтропии s, на оси температур (ординат) наносится шкала, на оси энтропий (абсцисс) шкала не наносится. Начало построения на оси энтропий выбирается произвольно (см. рис.4): если s > 0 (см. табл. 2), то начало построения можно сместить к оси ординат, т.к. процесс пойдет вправо; если s < 0 (см. табл. 2), то начало построения следует сместить вправо, т.к. процесс пойдет влево.
– таким образом, выбрав произвольно начало построения цикла, восстанавливаем перпендикуляр к оси энтропий и проводим его до пересечения с температурой вначале цикла (процесса) Т1 – это будет точка 1 – точка начала цикла и процесса 1 – 2.
– откладываем от проекции точки 1 на оси энтропий значение изменения энтропии s1-2 в процессе 1 - 2 (см. табл. 2), если s > 0, то откладываем вправо, если s1-2 < 0, то откладываем влево и из полученной точки восстанавливаем перпендикуляр до пересечения с температурой в конце процесса Т2 - точка пересечения дает точку 2.
– соединяем точки 1 и 2 - процесс построен. Аналогично строятся все процессы цикла.
5. Для одного из процессов цикла (кроме изотермического) построить схему графического нахождения u, h, q. На данную схему следует нанести численные значения необходимых для подсчета величин. На схеме приводятся абсолютные температуры в начале и конце процесса, изменение энтропии в процессе (для определения q) и изменения энтропии sv и sp (для определения u и h). Необходимо разобраться в площадях, соответствующих всем определенным величинам. При графическом исследовании процессов в диаграмме для простоты их заменяют прямыми линиями (Рис. 4).
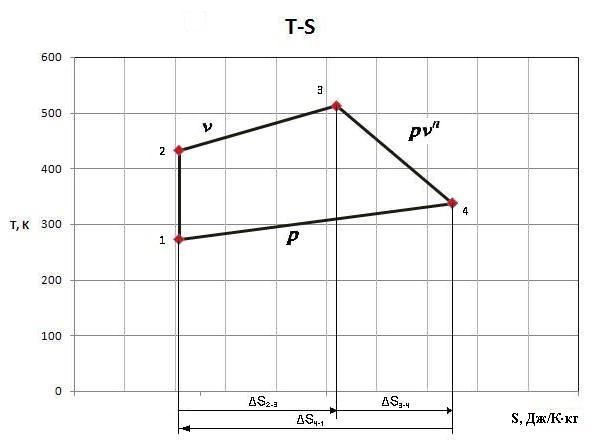
Рис. 4
Для лучшего уяснения графического решения рассмотрим примеры построения всех процессов рассматриваемого цикла.:
– на рис. 5 приведен в диаграмме процесс 1– 2 – адиабатный:
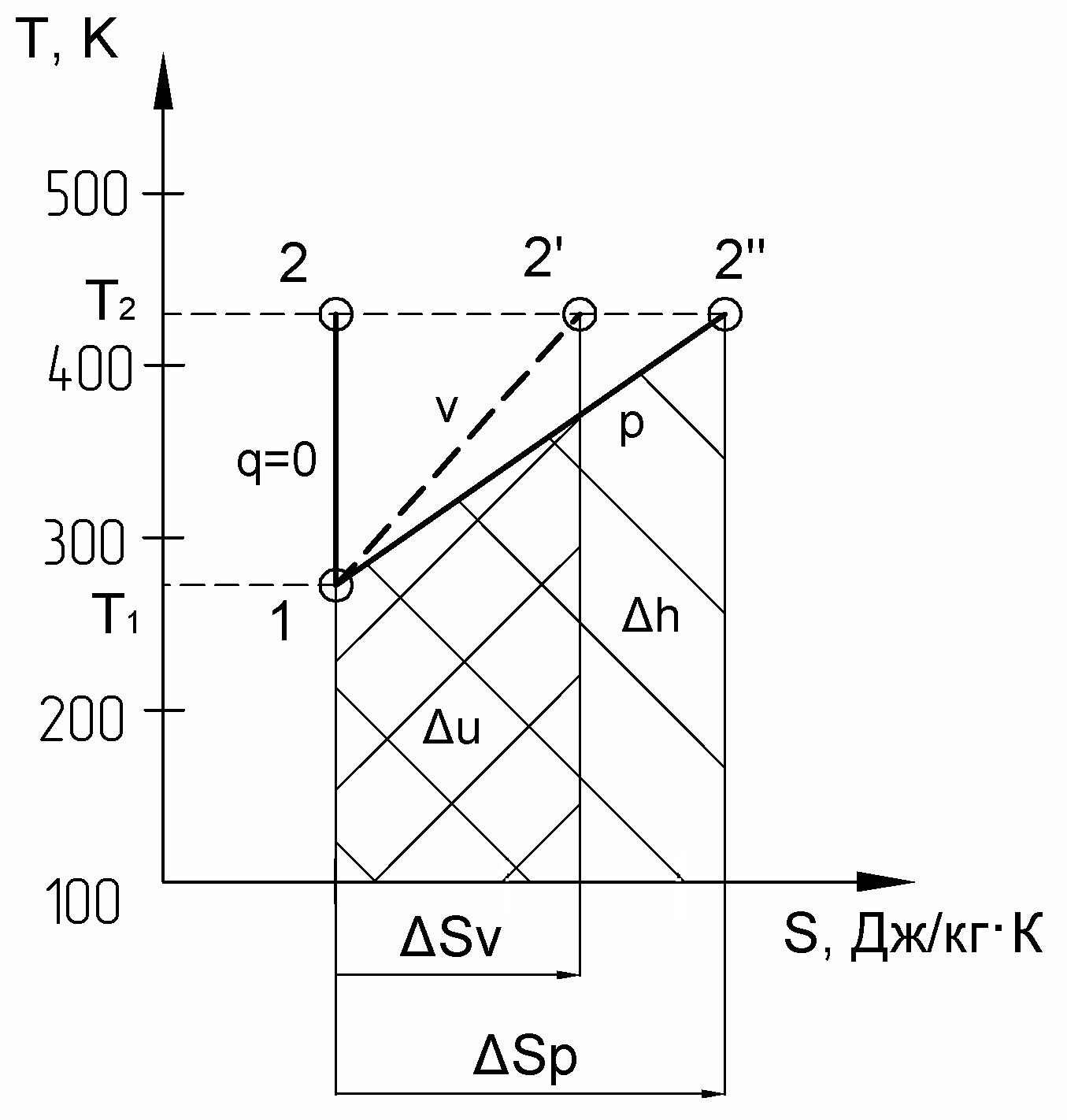
Рис. 5
– площадь под адиабатой равна нулю, т.к. q = 0;
– площадь под изохорой, проведенной в данном интервале температур, численно равна изменению внутренней энергии в процессе 1– 2:
u = u2 – u1 = пл. а12б = sv 0,5(T1 + T2) = 0,340 0,5 (273 +433) = 120 [кДж/кг],
где sv = cv ln (Т2/Т1) = 0,738 ln (433/273) = 0,340 [кДж/кг K],
т.к. sv > 0, то его численное значение откладывается в масштабе от точки а вправо и получаем точку б, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 2, соединяя точки 1 и 2 получаем изохору 1– 2.
– площадь под изобарой, проведенной в данном интервале температур, численно равна изменению энтальпии в процессе 1– 2:
h = h2 – h1 = пл. а12в = sp 0,5(T1 + T2) = 0,473 0,5 (273 +433) = 167 [кДж/кг],
где sp = cp ln (Т2/Т1) = 1,025 ln (433/273) = 0,473 [кДж/кг K],
т.к. sp > 0, то его численное значение откладывается в масштабе от точки а вправо и получаем точку в, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 2, соединяя точки 1 и 2 получаем изобару 1– 2.
б) – на рис. 6 приведен в диаграмме процесс 2 – 3 –изохорный:
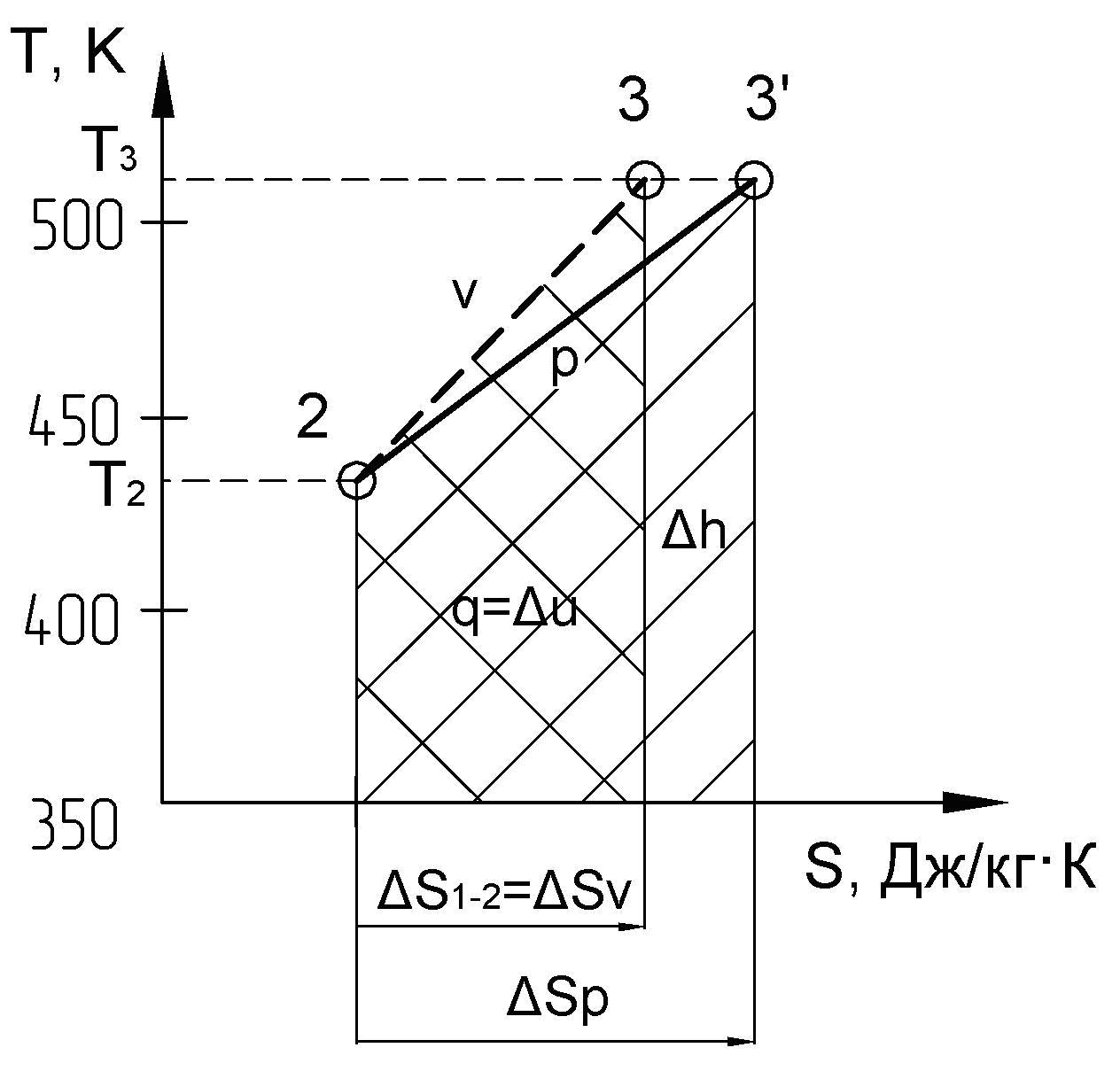
Рис. 6
– площадь под изохорой пл. а23б равна количеству теплоты, подведенной в процессе 2 – 3 и численно равна изменению внутренней энергии в этом процессе v = const:
где из таблицы №2 имеем sv = 0,125 [кДж/кг K]:
q = u = u3 – u2 = пл. а23б = sv 0,5(T2 + T3) = 0,125 0,5 (433 + 513) = 59 [кДж/кг],
т.к. sv > 0, то его численное значение откладывается в масштабе от точки а вправо и получаем точку б, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 3 (см. пункт 4), соединяя точки 2 и 3 получаем изохору 2 – 3.
– площадь под изобарой пл. а23в, проведенной в данном интервале температур, численно равна изменению энтальпии в процессе 2 – 3:
h = h3 – h2 = пл. а23в = sp 0,5(T2 + T3) = 0,174 0,5 (433 +513) = 82,3 [кДж/кг],
где sp = cp ln (Т3/Т2) = 1,025 ln (513/433) = 0,174 [кДж/кг K],
т.к. sp > 0, то его численное значение откладывается в масштабе от точки а вправо и получаем точку в, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 3, соединяя точки 1 и 3 получаем изобару 2 – 3.
в) – на рис. 7 приведен в диаграмме процесс 3 – 4 – политропный:
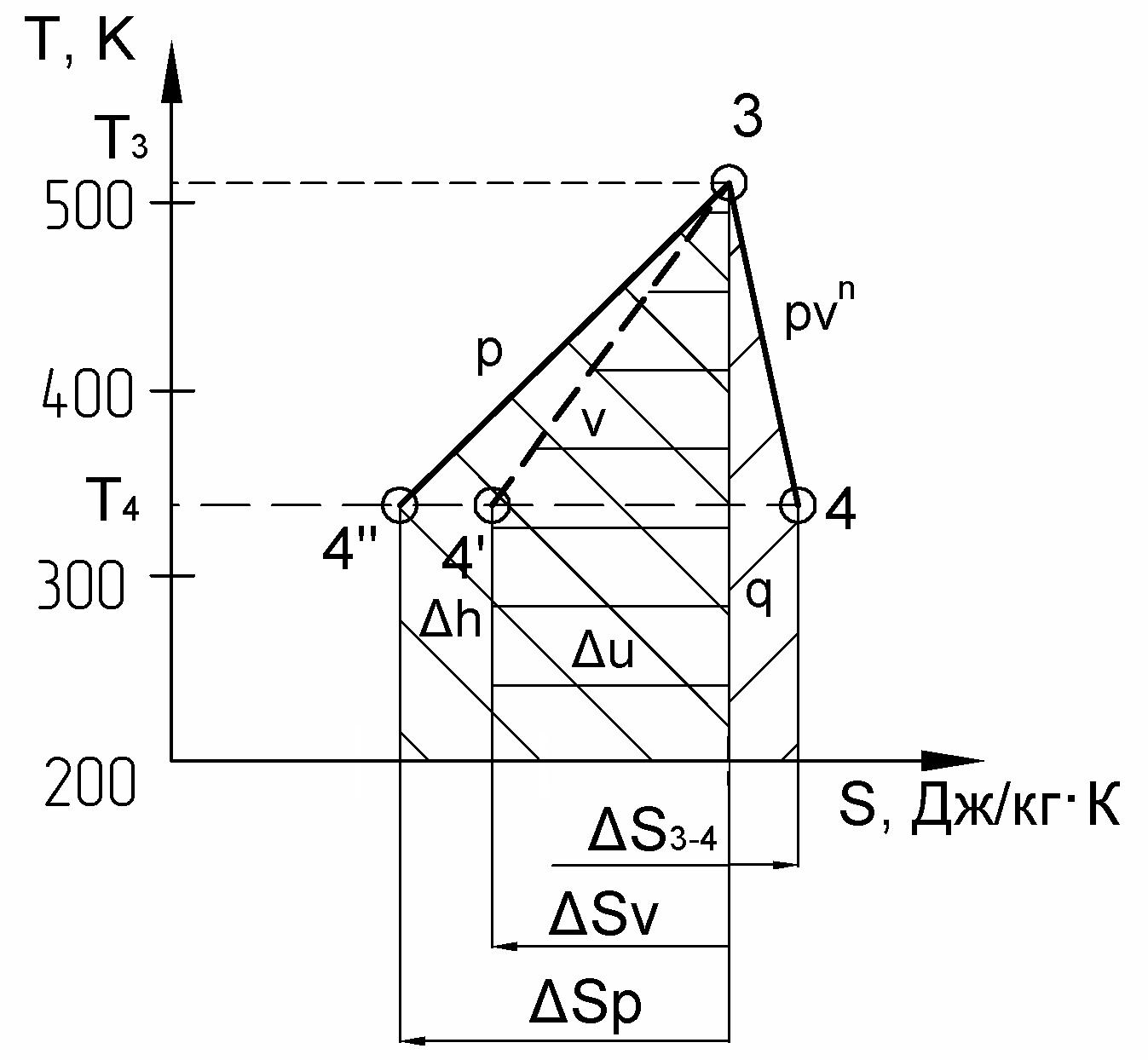
Рис. 7
– площадь под политропой пл. а34б равна количеству теплоты, подведенной в процессе 3 – 4:
где из таблицы №2 имеем s3-4 = 0,092 [кДж/кг K]:
q = пл. а34б = s3-4 0,5(T3 + T4) = 0,092 0,5 (513 + 338) = 39,14 [кДж/кг]:
u = u4 – u3 = пл. а34в = sv 0,5(T3 + T4) = – 0,308 0,5 (513 + 338) = – 131 [кДж/кг],
где sv = cv ln (Т4/Т3) = 0,738 ln (338/513) = – 0,308 [кДж/кг K],
т.к. sv < 0, то его численное значение откладывается в масштабе от точки а влево и получаем точку в, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 4, соединяя точки 3 и 4 получаем изохору 3 – 4.
– площадь под изобарой пл. а34с, проведенной в данном интервале температур, численно равна изменению энтальпии в процессе 3 – 4:
h = h3 – h2 = пл. а34с = sp 0,5(T2 + T3) = – 0,428 0,5 (513 +338) = –182,1 [кДж/кг],
где sp = cp ln (Т4/Т3) = 1,025 ln (338/513) = – 0,428 [кДж/кг K],
т.к. sp < 0, то его численное значение откладывается в масштабе от точки а влево и получаем точку с, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 4, соединяя точки 3 и 4 получаем изохору 3 – 4,
г) – на рис. 8 приведен в диаграмме процесс 4 – 1 –изобарный:
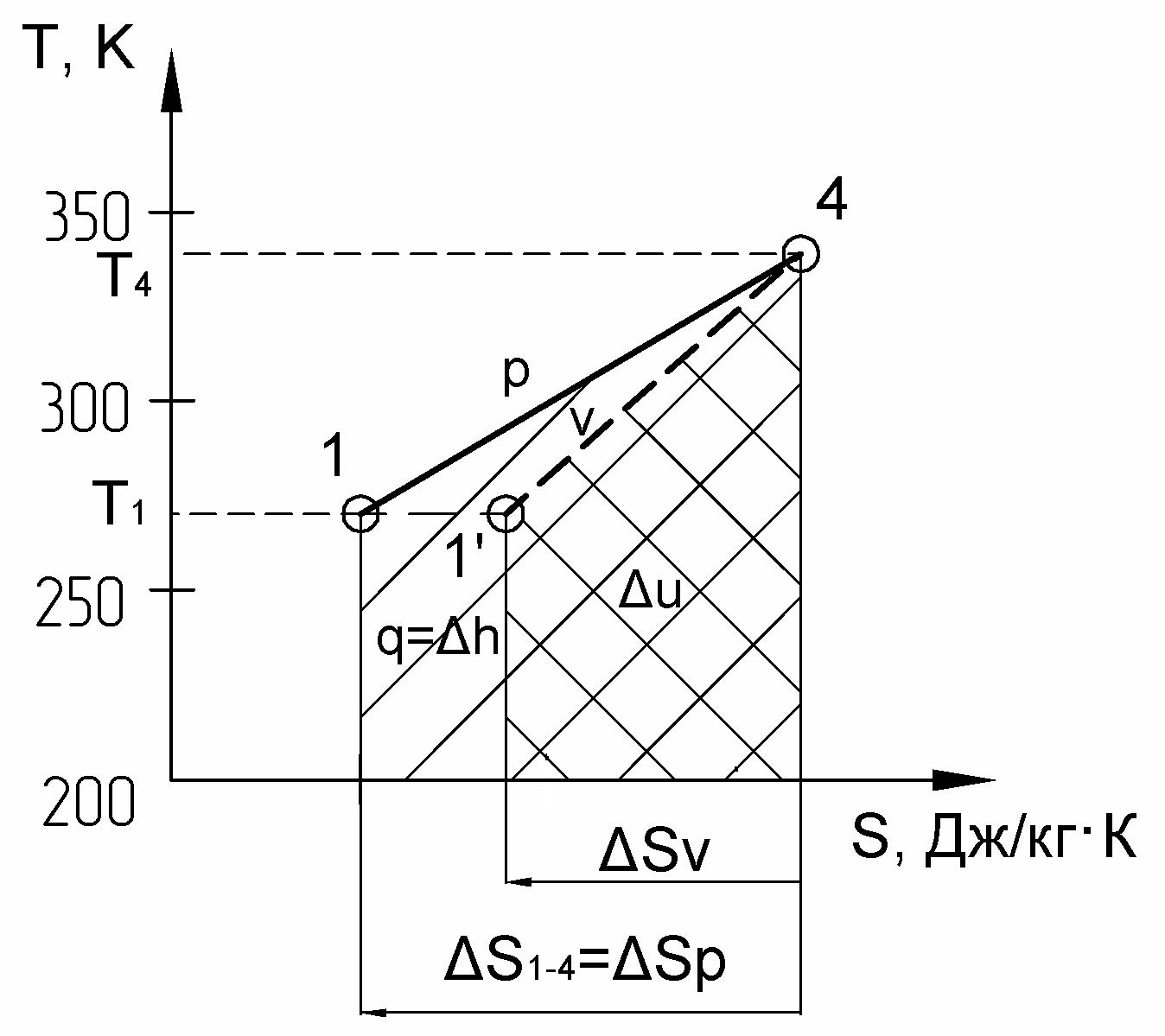
Рис. 8
– площадь под изобарой пл. а41б равна количеству теплоты, подведенной в процессе 4 – 1 и численно равна изменению энтальпии в этом процессе p = const:
где из таблицы №2 имеем sp = – 0,21 [кДж/кг K]:
q = h = h1 – h4 = пл. а41б = sp 0,5(T1 + T4) = – 0,21 0,5 (338 + 273) = - 64,2 [кДж/кг],
т.к. sp 0, то его численное значение откладывается в масштабе от точки а влево и получаем точку б, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 1 (см. пункт 4), соединяя точки 4 и 1 получаем изобару 4 – 1.
– площадь под изохорой пл. а41в, проведенной в данном интервале температур, численно равна изменению внутренней энергии в процессе 4 – 1:
u = u1 – u4 = пл. а41в = sv 0,5(T4 + T1) = – 0,158 0,5 (338 + 273) = – 48,2 [кДж/кг],
где sv = cv ln (Т1/Т4) = 0,738 ln (273/338) = – 0,158 [кДж/кг K],
т.к. sv 0, то его численное значение откладывается в масштабе от точки а влево и получаем точку в, из которой восстанавливается перпендикуляр до пересечения с температурой в конце процесса в точке 1, соединяя точки 4 и 1 получаем изобару 4 – 1.
