
- •1. Гомогенный и гетерогенный катализ
- •2. Дезактивация катализаторов
- •Дезактивация гомогенных катализаторов
- •Дезактивация гетерогенных катализаторов
- •Физические механизмы дезактивации
- •Рекристаллизация, спекание
- •2.2.3. Механическое разрушение гранул катализатора в результате истирания и/или измельчения
- •2.2.5. Блокировка поверхности катализатора
- •Химические механизмы дезактивации
- •2.2.6. Конкурирующая адсорбция вещества-яда на каталитически активном центре, препятствующая хемосорбции вещества-реагента
- •Литература
Введение:
Первой документированной датой, относящейся к явлению «катализ», считается 1480 год, когда один из алхимиков наблюдал образование диэтилового эфира из винного спирта в присутствии купоросного масла (серной кислоты) [1], а первый промышленный каталитический процесс был реализован в 1746 году в Бирмингеме, где J. Roebuck организовал производство серной кислоты, с использованием в качестве катализатора оксидов азота (…A catalyst was used industrially for the first time by J. Roebuck in the manufacture of lead chamber sulfuric acid in 1746…) [2]. Несмотря на то, что история катализа, как объекта научных исследований, не превышает 200 лет, уже к середине 80-х годов 20 века порядка 80 % химической продукции изготавливалась каталитическим путем [3], а в начале 21 века с помощью катализа получают 85 - 90 % продуктов химической переработки [4].
При широчайшем прикладном применении катализа, до сих пор не существует единой теории каталитического действия, которая обладала бы эвристической силой, т.е. могла бы предсказывать каталитические свойства веществ и теоретически рассчитывать скорости каталитических реакций. Более того, по образному выражению одного из известных ученых-каталитиков, «ни в одном из разделов современной науки человечество не затратило столь грандиозных усилий со столь ничтожными результатами, как в теории катализа». Менее эмоционально широко распространенное и во многом справедливое мнение, что катализ скорее искусство, чем наука [5]. Термин «катализатор» предложен шведским химиком Берцелиусом в 1835 году применительно к веществам, которые существенно ускоряют скорость химических реакций, не принимая в реакции видимого участия (как минимум, катализатор не «входит» в состав конечных продуктов реакции). Сatalysis (греч. ) – разрушение, таким образом, наиболее близкое значение термина катализатор – «разрушающий», «обладающий разрушительной силой» (исследуемые в то время химические реакции в подавляющем большинстве были именно реакциями разложения [6]).
Берцелиус предполагал, что катализаторы обладают особой способностью ослаблять связи между атомами в молекулах, участвующих в реакции, облегчая, таким образом, их взаимодействие.
Согласно Берцелиусу: «различные простые и сложные тела, растворимые и нерастворимые, обладают свойством оказывать на другие тела действие, весьма отличное от химического сродства. Они производят в этих телах разложение на составные элементы, а также вызывают различные новые сочетания этих элементов. При этом сами остаются неизменными. Эта новая сила, до сих пор остававшаяся неизвестной, свойственна как органической, так и неорганической природе».
В определении катализа как явления, предложенного Берцелиусом, содержится, по существу, указание о существовании неизвестной каталитической силы, природа которой была непонятна. При этом Берцелиус полагал, что без катализатора химические реакции вообще не могут протекать. Однако в 1850 г, на примере гидролиза сахара в присутствии минеральных кислот, Вильгельми показал, что роль катализатора сводится к увеличению скорости реакции, которая в принципе может протекать и без него. В работах Оствальда (1884-1901 гг.) это положение было отмечено неоднократно. В конечном итоге оно послужило основой для следующей формулировки: «Катализатор — это вещество, которое, не входя в конечный продукт химической реакции, изменяет ее скорость».
Такая формулировка допускала возможность существования как положительного (увеличение скорости), так и отрицательного (уменьшение скорости) катализа. Однако к настоящему времени нет ни экспериментального, ни теоретического обоснования, позволяющего предполагать возможность в присутствии катализатора замедления химического взаимодействия между молекулами путём увеличения энергии активации или уменьшения предэкспненциального множителя в уравнении Аррениуса. Руководствуясь этими данными (или их отсутствием) комиссия по терминологии IUPAC рекомендовала исключить термин «отрицательный катализ» из употребления.
В ряде учебников и монографий последних десятилетий можно найти несколько определений термина «катализ» отражающих наиболее существенные признаки этого явления. Обобщая их совокупность авторы [7] используют следующее определение для катализа, как явления: «Катализ — это избирательное ускорение одного из термодинамически возможных направлений реакции в присутствии веществ (катализаторов) многократно вступающих в промежуточные химические взаимодействия с субстратами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав».
Сравним данную формулировку с тем как явление «катализ» интерпретировал крупнейший специалист в области катализа, выдающийся советский ученый и инженер-химик Георгий Константинович Боресков: «…возбуждение химических реакций или изменение их скорости под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав» [8].
Как видно, речь идет о возбуждении химических реакций, а не только об их ускорении. В чем же отличие? В качестве примера авторы работы [9] приводят три термодинамически возможные реакции окисления этилена молекулярным кислородом:
C2H4 + O2 CO2 + H2O G = -1300 кДж/моль
C2H4 + O2 CH3CHO (ацетальдегид) G = -200 кДж/моль
C2H4 + O2 C2H4O (оксид этилена) G = -80 кДж/моль
Первая реакция - глубокое окисление с образованием диоксида углерода и воды. Данная реакция протекает без катализатора при температуре 500 – 600 ºС, а в присутствии катализатора может быть осуществлена при 100 ºС. В этом случае катализатор ускоряет реакцию, поскольку она протекает при более низкой температуре.
Два других направления реакции между этиленом и кислородом – окисление до ацетальдегида и окисление до оксида этилена. Обе реакции требуют обязательного присутствия катализатора, следовательно, с помощью катализатора можно возбудить химические реакции, а не только их ускорить.
Вывод (применительно к любым системам): катализ может быть использован для осуществления протекания любых термодинамически возможных химических реакций.
С позиций ускоряющего действия катализаторов, отметим, что оно принципиально отличается от действия других факторов, интенсифицирующих процесс: катализатор снижает энергию активации процесса в результате изменения реакционного пути. Напомним, что путь реакции – это последовательность промежуточных состояний от исходного (реагенты) до конечного (продукты), через которые проходит система в ходе химического превращения (…а catalyst increases the reaction rate or activity relative to an uncatalyzed process by providing a less energetic pathway for conversion of reactants to products…) [10] - (рис. 1).
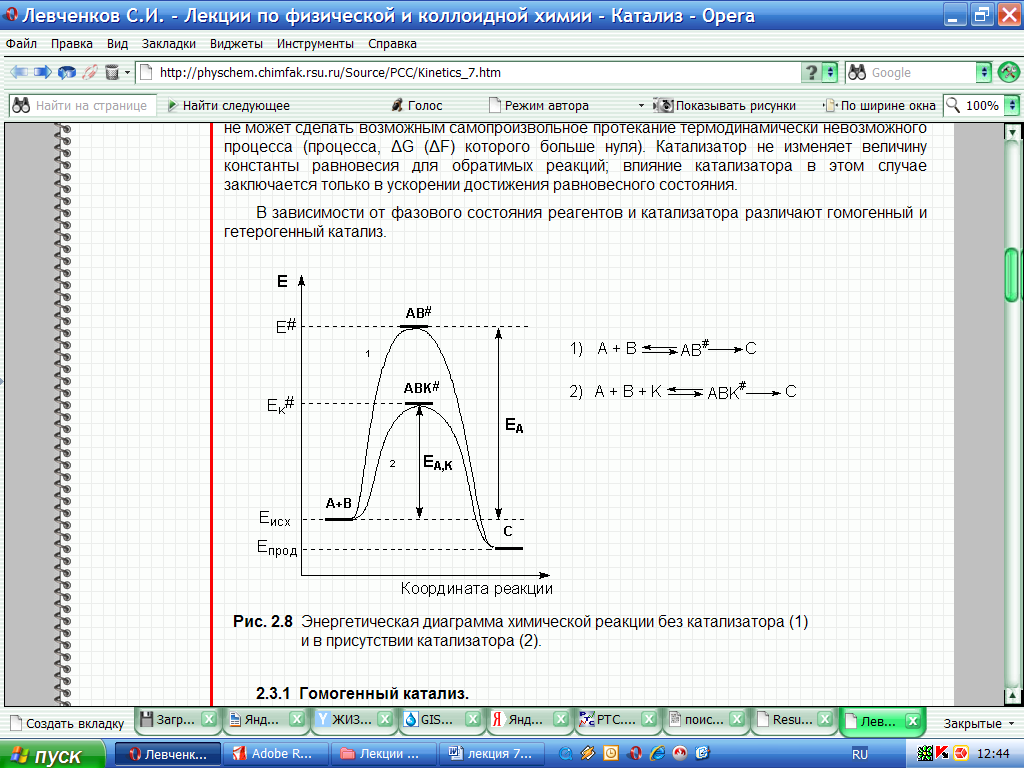
Рисунок 1 – Энергетическая диаграмма химической реакции без катализатора (1) и в присутствии катализатора (2)
С позиций возбуждения термодинамически возможной химической реакции, отметим, что наличие катализатора в системе не влияет на величину изменения энергии Гиббса. Рассмотрим одну и ту же реакцию, протекающую не каталитически и в присутствии катализатора:
А + В ® С + D (1)
А + В + Кат ® С + D + Kат (2)
где А, В – исходные вещества, C, D – продукты реакции, Кат – катализатор.
Изменение энергии Гиббса при протекании химической реакции является суммой энергий Гиббса образования реагентов и продуктов, с учетом величины и знака стехиометрических коэффициентов (плюс для продуктов, минус для реагентов):
DG1 = DGС + DGD - DGA - DGB
DG2 = DGС + DGD + DGКат -DGA - DGB - DGКат (поскольку катализатор в одинаковой форме присутствует и в левой и в правой части химического уравнения).
Как видно DG1 = DG2, из чего следуют два вывода:
1. Использование катализатора не может вызвать термодинамически невозможную реакцию (ориентировочно, если ∆G > + 40 кДж/моль);
2. Катализатор не влияет на положение равновесия обратимой реакции (поскольку не меняется энергия Гиббса, не меняется и величина константы равновесия G =-RTlnK).
Отметим, что катализатор, ускоряя как прямую, так и обратную реакцию, способствует более быстрому достижению положения равновесия.
1. Гомогенный и гетерогенный катализ
В зависимости от фазового состояния катализатора и реагентов различают катализ гомогенный и гетерогенный. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества.
Типичные катализаторы для гомогенного катализа - протонные и апротонные кислоты (H2SO4, HF, орто- и пара- толуолсульфокислоты, AlCl3), основания (пиридин, аммиак, имидазол), комплексы металлов (Pd, Rh, Co, Ni).
В качестве гетерогенных катализаторов обычно используют твердые вещества. В первую очередь это металлы и оксиды металлов:
- VIII группы (Fe, Co, Ni, Rh, Pd, Pt);
- I группы (Cu, Ag);
- V группы (V);
- VI группы (Cr, Mo, W);
- VII группы (Mn).
Для увеличения количества активных центров гетерогенного катализатора, каталитически активный компонент зачастую распределяют на поверхности так называемого носителя (англ. supported catalyst). В качестве носителя (англ. support или carrier) наиболее широко используют различные формы оксида алюминия, диоксид кремния, углеродные материалы (активированный уголь, графит), алюмосиликаты (цеолиты).
Реже применяются жидкие катализаторы, которые представляют собой кислоты, иногда растворы активных веществ в воде или органических растворителях.
Некоторые характеристики гомогенного и гетерогенного катализа приведены в табл.1.
Таблица 1 – Сравнительные характеристики гомогенного и гетерогенного катализа
Характеристика |
Катализ |
|
Гомогенный |
Гетерогенный |
|
1 |
2 |
3 |
Система |
Наиболее часто - жидкая среда с растворенным катализатором, редко газообразные реагенты и газообразный катализатор |
Наиболее часто - жидкая или газовая среда и твердый катализатор |
Активный центр |
Индивидуальная химическая частица (молекула, ион) |
Группа атомов на поверхности твердого тела (атомы, расположенные в объеме твердой фазы, в катализе не участвуют) |
Однородность активных центров |
Обычно однородная структура |
Обычно на поверхности присутствуют центры различной силы |
Где протекает каталитическая реакция |
Весь объем реакционной смеси, так как катализатор равномерно распределен по объему системы |
Только граница раздела катализатор - реакционная смесь |
Селективность катализатора |
Высокая (вплоть до специфичности) |
Ниже, чем у гомогенных катализаторов |
Влияние диффузии на скорость каталитической реакции |
Отсутствует |
В большинстве случаев необходимо создать условия для интенсификации массообмена |
Продолжение табл. 1 |
||
1 |
2 |
3 |
Теплообмен с окружающей средой |
Легко организуемый |
Сложно организуемый |
Термическая устойчивость |
Может быть низкой (металлокомплексные катализаторы) |
Высокая |
Стоимость изготовления |
В большинстве случаев высокая |
В большинстве случаев низкая |
Срок службы |
Катализатор является «одноразовым», то есть используется в единичном технологическом цикле |
В большинстве случаев срок службы катализатора составляет тысячи часов (до 5 лет эксплуатации) |
Дезактивация (ухудшение, вплоть до потери) каталитических свойств в процессе эксплуатации |
Дезактивация всегда необратима |
Во многих случаях каталитические свойства могут быть восстановлены |
Выделение катализатора из реакционной смеси |
Сложный и дорогостоящий способ (например, дистилляция) |
Простой и относительно недорогой способ (например, фильтрация) или вообще не требуется в случае реактора с неподвижным слоем катализатора |
Механизм катализа |
Обязательной стадией является химическая реакция между катализатором и реагентом, подчиняющаяся законам химической кинетики |
Обязательной стадией является химическая адсорбция (хемосорбция) как минимум одного из реагентов на каталитическом центре |
Отметим, что существуют катализаторы, которые не могут быть строго отнесены к гомогенным или гетерогенным. В качестве примера приведем твердые полимеры с кислотными функциональными группами, относящиеся к ионообменным смолам (катионитам). Такие катализаторы применяются вместо гомогенных для множества химических реакций, например, гидролиза, гидратации и дегидратации, этерификации, димеризации олефинов, конденсации.
Примеры конкретных реакций, катализируемых катионитами, реализованных в промышленных масштабах [11, 12]: дегидратация третбутанола; синтез метил-третбутилового эфира; гидратация олефинов С2 – С5 до соответствующих спиртов; одностадийный синтез изопрена из 1,3,5-триоксана и триметилкарбинола; - синтез бисфенола А (БФА) путем конденсации фенола и ацетона.
Последнее производство входит в состав ОАО «КазаньОргсинтез» (г. Казань) и является самым новым из действующих на предприятии. В начале октября 2004 года ОАО "КазаньОргсинтез" совместно с ОАО "ТАИФ" подписал контракты на закупку лицензий и базового проектирования для производства БФА с японской фирмой "Идэмицу Косан Корпорейшн" (Idemitsu Kosan Co., Ltd). в октябре 2007 года завод приступил к промышленному выпуску целевого продукта бисфенола-А в гранулированном виде [13].
