
- •Тройные соударения и тримолекулярные реакции
- •Теория соударений
- •Сечение процесса
- •Зависимость константы скорости тримолекулярной реакции от температуры
- •Тримолекулярные реакции в теории активированного комплекса
- •Cхема тримолекулярных взаимодействий, использующая симметризованный набор бимолекулярных актов
- •Список использованной литературы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ, МОЛОДЕЖИ И СПОРТА УКРАИНЫ
ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Курсовая работа по физической химии
на тему:
«Тримолекулярные реакции»
Преподаватель:
к.х.н. Белая Н.И.
Донецк 2012
Содержание
Введение 3
Тройные соударения и тримолекулярные реакции 4
Теория соударений 7
Сечение процесса 10
Зависимость константы скорости тримолекулярной реакции от температуры 11
Тримолекулярные реакции в теории активированного комплекса 14
Cхема тримолекулярных взаимодействий, использующая симметризованный набор бимолекулярных актов 15
Вывод 22
Список использованной литературы 23
Введение
Результатом любого химического процесса является перестройка частиц исходных веществ в частицы продуктов реакции. Каждое превращение исходной или промежуточной частицы или нескольких частиц при их непосредственном взаимодействии друг с другом, приводящее к изменению их химического строения, является элементарным актом химического превращения. Совокупность всех химически однотипных элементарных актов составляет элементарную реакцию, или элементарную стадию химического превращения. Перестройка частиц реагентов в частицы продуктов может происходить в один элементарный акт или путем нескольких последовательных элементарных актов [2].
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы.
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных)
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц
Реакции с молекулярностью более трёх неизвестны.
Целью моей курсовой работы является изучение тримолекулярных реакций на основе доступных современных отечественных и зарубежных литературных источников.
Тройные соударения и тримолекулярные реакции
В качестве элементарных реакций в газовой фазе тримолекулярные соударения не являются распространёнными, поскольку даже в хаотических броуновских движениях очень мала вероятность одновременных столкновений трёх частиц. Вероятность тримолекулярной стадии резко возрастает, если она протекает на границе раздела фаз, и фрагменты поверхности конденсированной фазы оказываются её участниками. За счёт подобных реакций часто создаётся основной канал изъятия у активных частиц избыточной энергии и их исчезновения в сложных превращениях.
Рассмотрим
тримолекулярное превращение вида:![]()
Качественная модель последовательных бимолекулярных соударений:
А + В → АВ АВ + С → Продукты
А + С → АС АС + В → Продукты
С + В → СВ СВ + А→ Продукты
Основное допущение основано на детальном равновесии на первой стадии:
Квазиравновесный режим образования бимолекулярных комплексов
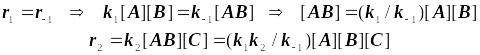
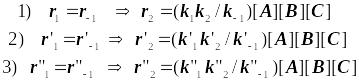
![]()
![]()
Результирующая константа скорости должна принять вид:
![]()
Комбинация трёх энергий активации создаёт формальное разнообразие возможных вариантов механизма (рис. 1).
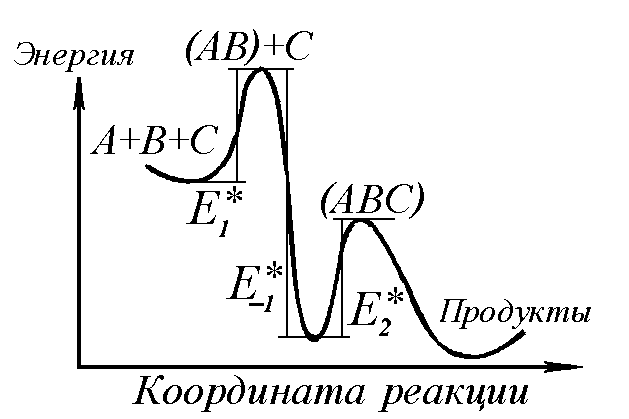
Рисунок 1 "Зависимость энергии активации от координаты реакции"
При этом «наблюдаемая» энергия активации тримолекулярной реакции может оказаться и отрицательной величиной.
Для реакции :
2NO + O2 → 2NO2
![]()
Подобная трактовка тримолекулярных реакций принадлежит Траутцу. Её не следует переоценивать. Это лишь качественная теория. Она не в состоянии объяснить все особенности таких реакций. Это возможно лишь на основе ТАК, которая не ограничена лишь вышеприведенным простейшим выводом, и требует значительно более глубокого анализа на основе статистической механики.
Тримолекулярная реакция валентно-ненасыщенных частиц:
2NO + O2 → 2NO2
2NO + Cl2 → 2NOCl
2NO + H2 → N2O + H2O
Cтехиометрические уравнения баланса вовсе не обязаны соответствовать схеме элементарных актов.
Тримолекулярными являются также очень важные реакции рекомбинации валентно-насыщенных частиц в превращениях типа:
![]() ,
,
где R1, R2- обладающие свободной валентностью атомы или молекулярные свободные радикалы, а M - любая третья частица. С формально-кинетической точки зрения всякий такой процесс выглядит как процесс второго порядка, и третья частица не учитывается в материальном балансе и не определяет стехиометрию процесса.
Её функция состоит только лишь в отводе избытка энергии от образующейся частицы
![]()
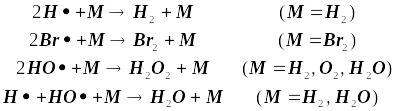
Тримолекулярные процессы подобного рода протекают на стенках сосуда, и символом M будут уже обозначены центры соударения на стенке. Их присутствие без специальных приёмов не обнаружимо, и роль этих стадий будет замаскирована в виде концентрационных сомножителей в эффективных константах скоростей. Роль таких стабилизирующих тройных столкновений тем выше, чем более эффективно они способны отводить выделяющуюся избыточную энергию, а она тем выше, чем больше атомов в молекуле третьей частицы M. Это вызвано тем, что с увеличением размера частицы растёт число колебательных степеней свободы, и за счёт именно их возбуждений растёт вероятность отвода энергии на межатомные связи молекулы M от вновь образуемой молекулы продукта [6].
