
- •БиоОрганичесКая химИя
- •Часть I
- •060101 – «Лечебное дело»
- •Оглавление
- •Введение
- •1. Классификация и номенклатура биологически важных органических соединений
- •Вопрос 1. Как классифицируются органические соединения?
- •Вопрос 2. Какие виды номенклатуры органических соединений используются в настоящее время?
- •Вопрос 3. Как правильно назвать органическое соединение по систематической номенклатуре?
- •Вопрос 4. Какие признаки положены в основу классификации органических соединений?
- •Вопрос 5. Как правильно отнести данный углеводород
- •Вопрос 7. Как определить класс и дать название по систематической номенклатуре следующему соединению:
- •Вопрос 8. Как определить класс и дать название по систематической номенклатуре следующему соединению:
- •Вопрос 9. Как определить класс и дать название по систематической (международной) и рациональной номенклатурам следующим соединениям:
- •Вопрос 10. Как правильно написать формулу и дать название вторичного спирта, содержащего 4 атома углерода?
- •Вопрос 11. Как написать формулу и название (по международной номенклатуре) тиола, содержащего 3 атома углерода и отметить в этом соединении вторичный атом углерода?
- •Вопрос 12. Как написать формулу и название амида кислоты, содержащей 4 атома углерода?
- •Вопрос 13. Как из представленных формул выбрать те, которые изображены неправильно?
- •Вопрос 14. Как из предложенных названий:
- •Вопрос 15. Соответствует ли правилам Международной номенклатуры название 2-метил-4-бутанол?
- •2. Строение органических соединений
- •Вопрос 16. Как можно охарактеризовать понятие: строение органических соединений?
- •Вопрос 22. Что такое конфигурация молекулы?
- •Вопрос 23. Что такое конформация молекулы?
- •Вопрос 24. Что такое гомологический ряд?
- •Вопрос 25. Как написать формулу гомолога бутановой кислоты, имеющего на два атома углерода больше?
- •Вопрос 26. Как написать формулу гомолога бутаналя, имеющего на четыре атома водорода меньше?
- •Вопрос 27. Как написать формулу изомера пентановой кислоты по строению углеродной цепи?
- •Вопрос 28. Как написать формулу изомера 1-пентена по положению кратной связи?
- •Вопрос 29. Как написать формулу изомера бутаналя по функциональной группе?
- •Вопрос 31. Как определить, к какому типу изомеров относятся олеиновая и элаидиновая кислоты?
- •Вопрос 32. Как определить, к какому типу изомеров относятся соединения: бутановая кислота и метиловый эфир пропановой кислоты?
- •Вопрос 33. Как определить, к какому типу изомеров относятся соединения: 1-бутанол и 2-бутанол?
- •Вопрос 34. Как определить, являются ли изомерами лейцин и изолейцин?
- •3. Общие закономерности реакционной способности органических соединений
- •Вопрос 35. Как определить, какой тип реакций наиболее характерен для соединений, относящихся к тому или иному классу органических соединений?
- •Вопрос 36. Как по уравнению реакции определить, к какому типу химических реакций она относится?
- •Вопрос 37. Как правильно написать уравнение реакции и определить её механизм?
- •Вопрос 38. Какой продукт преимущественно образуется в результате реакции бромирования 3-метилпентана?
- •Вопрос 39. Назовите продукт взаимодействия 2-бутеновой кислоты с бромоводородом в присутствии перекиси и без неё.
- •Вопрос 40. В процессе метаболизма в живых организмах фумаровая кислота превращается в яблочную. Каким путем можно получить яблочную кислоту из фумаровой in vitro?
- •Вопрос 41. R-2-бромбутан может реагировать с водным раствором гидроксида натрия по механизмам sn1 и sn2. Опишите стереохимический результат реакции в каждом случае.
- •Вопрос 44. Каков внешний эффект взаимодействия олеата натрия с бромной водой?
- •4. Аминокислоты, пептиды, белки
- •Вопрос 45. Какие соединения относятся к - аминокислотам? Какова роль -аминокислот в функционировании живых организмов?
- •Вопрос 46. Как построить формулы стереоизомеров (энантиомеров) -аминокислот? Все ли природные -аминокислоты оптически активны?
- •Вопрос 47. Как проявляются кислотно-основные свойства и амфотерность -аминокислот? Какие свойства -аминокислот обуславливает их ионное строение?
- •Вопрос 48. Как определить, какую реакцию среды имеют растворы -аминокислот в дистиллированной воде?
- •Вопрос 49. Что такое «изоэлектрическая точка - аминокислоты»? Каким образом - аминокислоты перемещаются в электрическом поле?
- •Вопрос 51. С помощью какой реакции можно превратить изолейцин в 3-метил-2-пентеновую кислоту? а серин в 2- аминоэтанол?
- •Вопрос 53. Какие соединения образуются при взаимодействии в организме валина и пировиноградной кислоты?
- •Вопрос 54. Что представляют собой пептиды? в чём состоит их отличие от белков? в результате каких реакций образуются пептиды в организме?
- •Вопрос 56. Охарактеризуйте первичную, вторичную, третичную и четвертичную структуры белков.
- •Вопрос 57. Как классифицируются белки?
- •Вопрос 58. Какие качественные реакции используют для определения аминокислот и белков?
- •Вопрос 59. Можно ли с помощью ксантопротеиновой реакции (с азотной кислотой) отличить фенилаланин от тирозина? Если да, то в чем будет состоять различие? Если нет, объясните, почему.
- •Литература
Вопрос 56. Охарактеризуйте первичную, вторичную, третичную и четвертичную структуры белков.
Ответ. Первичная структура белков – это порядок чередования -аминокислот в полипептидной цепи (рис. 1):

Рисунок 1. Первичная структура инсулина
Аминокислоты связаны пептидными связями. Установить первичную структуру можно путём последовательного отщепления -аминокислот с конца молекулы и их идентификации.
Вторичная структура белка представлена двумя конформациями. Одна из вторичных структур белковой молекулы представляет собой спираль (эту структуру называют также - структурой или -спиралью). Эта конформация полипептидной цепи представляет собой правозакрученную спираль. Её можно представить, вообразив, что полипептидная цепь обвивает поверхность цилиндра, закручиваясь по часовой стрелке (вправо). На один виток спирали в среднем приходится 3,6 аминокислотных остатков (36 остатков на 10 витков); шаг спирали (расстояние между двумя соседними витками) – 0,54 нм; диаметр – 0,5 нм. Плоскости двух соседних пептидных групп располагаются под углом 105, а боковые радикалы -аминокислот находятся на наружной стороне спирали, т.е. направлены как бы от поверхности воображаемого цилиндра.
Главную роль в закреплении -спирали играют водородные связи, которые образуются между карбонильным атомом кислорода каждого первого и атомом водорода группы –NH– каждого пятого аминокислотного остатка (т.е. водородные связи образуются между пептидными связями, находящимися на соседних витках спирали). Водородные связи направлены почти параллельно оси -спирали. Обычно белковые цепи спирализованы не полностью и -спирали чередуются с линейными участками.
Другая вторичная структура полипептидов и белков – это - структура (складчатый лист или складчатый слой). Вытянутые полипептидные цепи укладываются в складчатые листы. Друг с другом цепи связаны многочисленными водородными связями между пептидными группами.
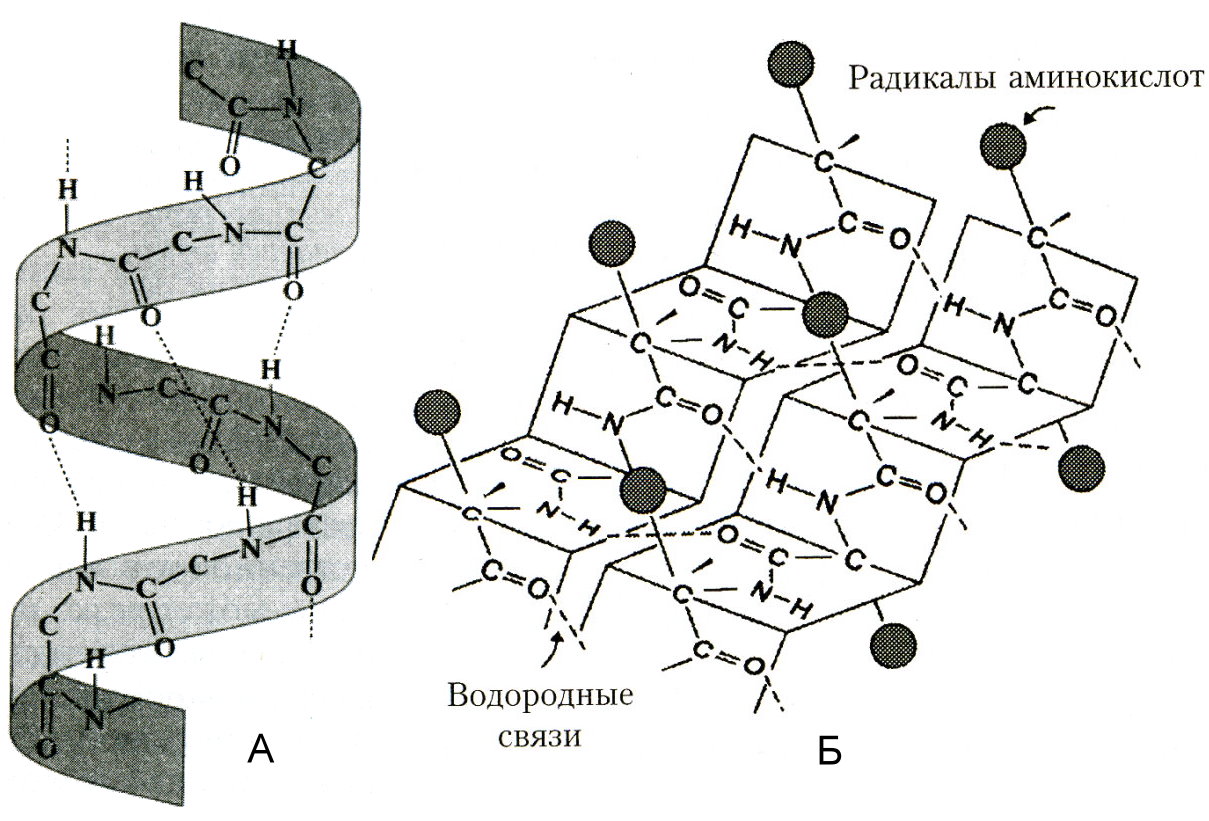
Рисунок 2. Вторичная структура белка: А – спиралевидная, Б – складчатая
Т ретичная
структура белка определяется общим
расположением в пространстве полипептидной
цепи, включающей элементы той или иной
вторичной структуры. Различают глобулярную
(шарообразную) и фибриллярную (вытянутые
нити) третичные структуры белков.
ретичная
структура белка определяется общим
расположением в пространстве полипептидной
цепи, включающей элементы той или иной
вторичной структуры. Различают глобулярную
(шарообразную) и фибриллярную (вытянутые
нити) третичные структуры белков.
Рисунок 3. Третичная структура белка: глобулярная и фибриллярная
При образовании третичной структуры полипептидные цепи изгибаются, при этом во взаимодействие могут вступать боковые радикалы -аминокислотных остатков, которые в неизогнутой цепи располагались далеко друг от друга. В образовании и стабилизации третичных структур белковых молекул участвует несколько видов связей.
Водородные связи возникают между функциональными группами боковых радикалов (например, между гидроксильными группами серина и треонина, или между гидроксильной группой и карбонильной группой глутамина или аспарагина), а также между функциональными группами боковых радикалов и атомами пептидной связи.
Ионные связи образуются за счёт электростатического взаимодействия между ионогенными (способными к образованию ионов) радикалами. Например, в радикале аспарагиновой кислоты (но не аспарагина!) содержится карбоксильная группа, которая не участвует в образовании пептидной связи. При её диссоциации образуется отрицательно заряженная группа –СОО–. В радикале лизина присутствует аминогруппа, не участвующая в образовании пептидной связи. Она способна присоединить протон и приобрести положительный заряд (–NH3+). Между этими заряженными группами и возникает ионная связь. Образовывать отрицательно заряженную группу может также глутаминовая кислота (но не глутамин!); положительно заряженные радикалы возможны кроме лизина, для аргинина и гистидина.
Гидрофобные взаимодействия (неполярные связи) возникают вследствие взаимного притяжения неполярных радикалов (не содержащих функциональных групп) за счёт сил Ван-дер-Ваальса. Этот вид связи характерен для радикалов аланина, валина, лейцина, изолейцина и т.д.
Дисульфидные связи образуются между меркаптогруппами, присутствующими в радикале цистеина. Группы –SH легко окисляются с образованием дисульфидных мостиков. Дисульфидных связей особенно много в кератине (белке волос и шерсти). Основные виды связей представлены на рис. 4.
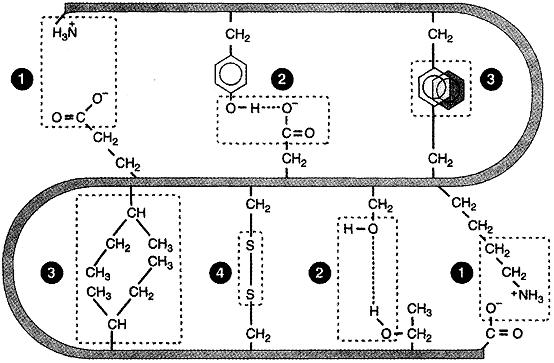
Рисунок 4. Схема образования ионных (1), водородных (2), гидрофобных (3), дисульфидных (4) связей между радикалами аминокислот при формировании третичной структуры
Четвертичная структура белка – комплекс из нескольких полипептидных цепей. При этом каждая цепь (субъединица) сохраняет характерные для неё первичную, вторичную и третичную структуры. Четвертичная структура удерживается за счет водородных связей и гидрофобных взаимодействий между субъединицами. Белок с четвертичной структурой выполняет биологические функции, несвойственные отдельно взятым субъединицам. Четвертичная структура характерна не для всех белков. Пример такого белка – гемоглобин, основная биологическая функция которого – перенос кислорода из лёгких к органам и тканям организма. Четвертичная структура этого белка представляет собой комплекс четырёх сложных белков, включающих полипептидную цепь (глобин) и небелковую часть (гем).
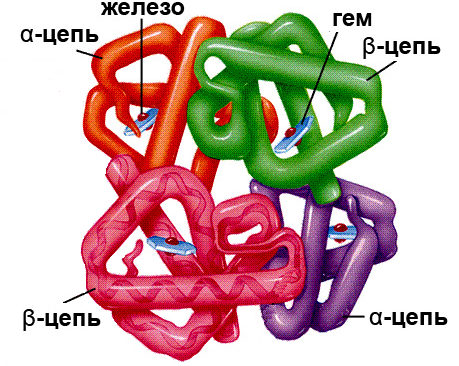
Рисунок 5. Строение четвертичной структуры гемоглобина
