- •Тема: Биохимия соединительной ткани
- •I Научно-методическое обоснование темы:
- •Катаболизм гликозаминогликанов
- •Волокнистые структуры соединительной ткани
- •Аминокислотный состав α-цепей коллагена
- •Синтез и формирование фибрилл коллагена
- •Фибриллогенез
- •Типы коллагена
- •Катаболизм коллагена
- •Эластин
- •Синтез эластина и формирование полимерных структур
- •Катаболизм эластина
- •II Цель деятельности студентов на занятии
- •IiIсодержание обучения:
- •IX Самостоятельная работа студентов:
- •VIII Хронокарта учебного занятия:
- •X Список используемой литературы:
Тема: Биохимия соединительной ткани
I Научно-методическое обоснование темы:
Ткани организма построены из клеток и внеклеточной жидкости, внеклеточный матрикс. В его состав входят разнообразные полисахариды и белки, которые самопроизвольно организуются в упорядоченную структуру.
В соединительной ткани – внеклеточный матрикс занимает большую часть, чем клетки.
Функции соединительной ткани:
Активный обмен метаболитами и ионами между кровью и тканями;
Формирование структур органов и тканей в эмбриогенезе и постнатальном периоде;
Подвижность трущихся поверхностей суставов, так как она образует покрывающий их хрящ;
Защиту от внешних воздействий, регулируя функциональное состояние фагоцитов и клеток иммунной системы;
Регенерацию и замещение дефектов путем стимулирования функциональной активности и пролиферации клеток ткани.
Формы соединительной ткани:
1.Минерализированная (зубы или кости);
2.Неминерализованная – все остальные виды соединительной ткани (прозрачное вещество роговицы глаза, сухожилия, кровь, лимфа, синовиальная жидкость и т.д.)
КЛАССИФИКАЦИЯ
А.СОБСТВЕННО СОЕДИНИТЕЛЬНАЯ ТКАНЬ:
|
Б.СКЕЛЕТНЫЕ СОЕДИНИТЕЛЬНЫЕ ТКАНИ:
|
В.СПЕЦИАЛЬНЫЕ ВИДЫ СОЕДИНИТЕЛЬНОЙ ТКАНИ:
|
|
Компоненты соединительной ткани
Клеточные элементы
|
Межклеточное вещество
|
3. Протеогликаны (ГАГ). |
|
Функции межклеточного матрикса:
Каркас органов и тканей
«Биологический» клей
Регуляция водно-солевого обмена
Образует высокоспециализированные структуры – кости, зубы, хрящи, сухожилия, базальные мембраны
Внеклеточный матрикс неминерализованной соединительной ткани образуют макромолекулы 2 основных классов: 1. протеогликаны (ГАГ) – присутствуют как в свободном виде, так и в связанном состоянии с белками (чаще всего) или липидами (такие связанные комплексы называют глюкоконъюгатами). 2. фибриллярные белки (структурные, адгезивные и неадгезивные)
ГАГ (табл.1.) – это длинные неразветвленные полисахаридные цепи, состоящие из повторяющихся полисахаридных звеньев –[А-В]n–.
Компоненты ГАГ (мономеры):
Гексуроновая кислота: бета-D-глюкуроновая кислота, бета-L-идуроновая кислота. В иногда - бета-D-галактоза.
Гексозамины представлены глюкозамином и галактозамином, а чаще их ацетильными производными: бета-D-N-ацетилглюкозамином, бета-D-N-ацетилгалактозамином.
Сульфатные и карбоксильные группы в структуре ГАГ придают ему отрицательный заряд.
Протеогликаны – ВМС, состоящие из белка (5-10 %) и ГАГ (90-95%); могут составлять до 50% сухой массы.
Функции ГАГ и протеогликанов
Структурные компоненты межклеточного матрикса
Специфически взаимодействуют с белками межклеточного матрикса
Являясь полианионами могут присоединять (кроме воды) большие кол-ва катионов (Na+, K+. Ca2+ и т.д.)
Защитная функция
Рессорная функция в суставных хрящах
ГС- создают фильтрационный барьер в почках; являясь компонентами плазматических мембран функционируют как рецепторы
КС- и ДС- обеспечивают прозрачность роговицы
Гепарин является антикоагулянтом
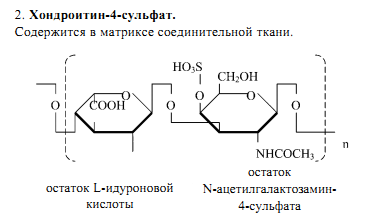
4 главные группы ГАГ: гиалуроновую кислоту, хондроитинсульфат и дерматансульфат, гепарансульфат и гепарин, кератансульфат.
Белковая часть составляет около 5 %. Таблица 1. ГАГ
1. Гиалуроновая кислота.
|
|
|
|
|
6. Гепарин. Антикоагулянт |
Синтез протеогликанов и ГАГ
Полипептидные цепи (коровый белок) протеогликанов синтезируется на рибосомах эндоплазматического ретикулума (ЭПР), а ГАГ образует главным образом в аппарате Гольджи. Предшествует синтезу полисахарида присоединение к остатку серина линкерного трисахарида (-ксилоза-галактоза-галактоза-), выполняющего роль затравки для роста ГАГ.(рис.1). Остальная часть цепи ГАГ, построенная из повторяющихся дисахаридных единиц (А и В), синтезируется путем последовательного присоединения углеводных. Синтез гиалуроновой кислоты катализируют гиалуронатсинтетазы, связанные с внутренней поверхностью плазматической мембраны. По мере удлинения полимерной цепи гиалуроновая кислота выводится через мембрану на наружную поверхность. Вне клетки гиалуроновая кислота может взаимодействовать с гиалуронат-связывающими белками и участвовать в образовании агрекана.
Структура ГАГ

Рис.1. Связь линкерного участка ГАГ с серином корового белка.
Каждую реакцию построения линкерного трисахарида и дальнейший рост цепи катализируют специфические гликозилтрансферазы. Сахара, участвующие в процессе предварительно активируются:
+УТФ
-Н4Р2О6
К силоза
– Р УДФ-ксилоза
силоза
– Р УДФ-ксилоза
Реакция заключается в прикреплении УМФ к фосфорилированному полисахариду (подобная реакция протекает при синтезе гликогена).
По завершении синтеза вся молекула протеогликана выходит из клетки. Синтезированные молекулы могут существенно различаться по количеству белка, длине, числе и типу гликозаминогликановых цепей в молекуле. Длина и состав цепей ГАГ могут сильно варьировать, также как и пространственное расположение гидроксильных, сульфатных и карбоксильных групп вдоль цепи.
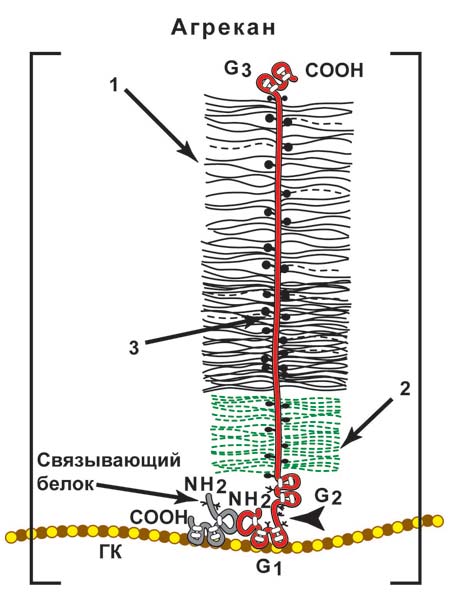
В межклеточном пространстве протеогликаны могут образовывать гигантские агрегаты с участием глюкуроновой кислоты, например агрекан (рис 2.).
Благодаря высокой плотности отрицательных зарядов полисахаридные цепи связывают множество осматически активных ионов: Na, Ca, K. Высокая концентрация ионов удерживает воду во внеклеточном матриксе, вызывая разбухание и загустевание матрикса. Например, молекула гиалуроновой кислоты может присоединять от 200 до 500молекул воды. Особая структура и способность к гидратации внеклеточного матрикса определяют степень жесткости в сочетании с эластичностью и упругостью. Комплексы протеогликанов и коллагенов в позвоночных и суставных дисках повышают их устойчивость к ударам, смягчая трение, возникающее между костями.
По мере удлинения цепи многие углеводные остатки модифицируются путем сульфирования, эпимеризации (перемещение функциональных групп в молекуле сахара). Источником –SО3- - групп является соединение 3`-фосфоаденозин-5`-фосфосульфат (ФАФС). Присоединение сульфатных групп значительно увеличивает отрицательный заряд протеогликанов.
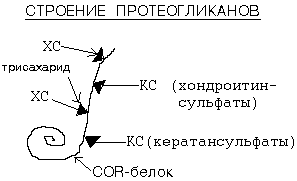
Образованная структура может включать более сотни протеогликановых мономеров, нековалентно присоединенных к одной молекуле гиалуроновой кислоты. Комплекс стабилизируют связывающие белки, которые одновременно соединены как с коровым белком протеогликана, так и с цепью гиалуроновой кислоты. Молекулярная масса такого образования может превышать 108 Д и занимать объем, равный бактериальной клетки. Такой сложный протеогликан, как агрекан, является основным структурным компонентом хрящевого матрикса, содержит более 100 цепей хондроитинсульфата и около 60 цепей кератансульфата.
Эти диски сдавливаются в течение дня, восстанавливают эластичность ночью, но постепенно деформируются с возрастом.
ГК - гиалуроновая кислота; 1 - хондроитинсульфат; 2 - кератансульфат; 3 - сердцевинный белок |
Рис 2. Строение агрекана В центре молекулы находится сердцевинный белок, имеющий три глобулярных домена: G1, G2, G3. G1 обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярным связывающим белком; G2 (?); G3 обеспечивает присоединение агрекана к другим молекулам межклеточного матрикса и, возможно, участвует в межклеточных взаимодействиях. Между доменами G2 и G3 находятся области, в которых к белку присоединяются кератансульфаты и хондроитинсульфаты. В этих областях в ко́ровом белке имеются пептидные участки, состоящие из 6 и 19 аминокислотных остатков, которые повторяются от 10 до 20 раз. |