
- •1. Чем объясняются высокие электро- и теплопроводность металлов?
- •5. Определите металлургическое качество, назначение, а также среднее содержание углерода и легирующих элементов в сталях: 20хн3а, сталь 20, у9, 5хв2с.
- •Контрольная работа 2
- •Назначение цементации и режим термической обработки после цементации.
- •С помощью диаграммы состояния железо-цементит обоснуйте выбор режима термической обработки, применяемой для устранения цементитной сетки в стали у11а.
- •Назначьте марку жаропрочной стали для изготовления тяжелонагруженных деталей, работающих при температурах до 600 оС. Укажите состав, назначьте и обоснуйте режим термической обработки стали.
- •Металлокерамические жаропрочные сплавы. Состав, свойства и область применения в машиностроении.
- •Литература
Государственное образовательное учреждение
Пермский Государственный Технический Университет
Кафедра металловедения и термической обработки металлов.
Контрольная работа по материаловедению.
Вариант 48.
Работу выполнил:
Барсаев Н. М.
студент 2 курса
МТФ ТМКУ-07
Работу проверила:
Некрасова Т. В.
г. Пермь, 2009 г.
ВАРИАНТ 48
КОНТРОЛЬНАЯ РАБОТА 1
1. Чем объясняются высокие электро- и теплопроводность металлов?
Классическая электронная теория металлов представляет твердый проводник в виде системы, состоящей из узлов кристаллической ионной решетки, внутри которой находится электронный газ из коллективизированных (свободных) электронов. В свободное состояние от каждого атома металла переходит от одного до двух электронов. К электронному газу применялись представления и законы статистики обычных газов. При изучении хаотического (теплового) и направленного под действием силы электрического поля движения электронов был выведен закон Ома.
При столкновениях электронов с узлами кристаллической решетки энергия, накопленная при ускорении электронов в электрическом поле, передается металлической основе проводчика, вследствие чего он нагревается. Рассмотрение этого вопроса привело к выводу закона Джоуля—Ленца.
Таким образом, электронная теория металлов дала возможность аналитически описать и объяснить найденные ранее экспериментальным путем основные законы электропроводности и потерь электрической энергии в металлах.
Оказалось возможным также объяснить и связь между электропроводностью и теплопроводностью металлов. Кроме того, некоторые опыты подтвердили гипотезу об электронном газов металлах, а именно:
1. При длительном пропускании электрического тока через цепь, состоящую из одних металлических проводников, не наблюдается проникновения атомов одного металла в другой.
2. При нагреве металлов до высоких температур скорость теплового движения свободных электронов увеличивается, и наиболее быстрые из них могут вылетать из металла, преодолевая силы поверхностного потенциального барьера.
3. В момент неожиданной остановки быстро двигавшегося проводника происходит смещение электронного газа по закону инерции в направлении движения. Смещение электронов приводит к появлению разности потенциалов на концах заторможенного проводника, и стрелка подключаемого к ним измерительного прибора отклоняется по шкале.
4. Исследуя поведение металлических проводников в магнитном поле, установили, что вследствие искривления траектории электронов в металлической пластинке, помещенной в поперечное магнитное поле, появляется поперечная ЭДС и изменяется электрическое сопротивление проводника.
Однако выявились и противоречия некоторых выводов теории с опытными данными. Они состояли в расхождении температурной зависимости удельного сопротивления, наблюдаемой на опыте и вытекающей из положений теории; в несоответствии теоретически полученных значений теплоемкости металлов опытным данным. Наблюдаемая теплоемкость металлов меньше теоретической и такова, как будто электронный газ не поглощает теплоту при нагреве металлического проводника.
Эти противоречия удалось преодолеть, рассматривая некоторые положения с позиций квантовой механики.
В отличие от классической электронной теории в квантовой механике принимается, что электронный газ в металлах при обычных температурах находится в состоянии вырождения. В этом состоянии энергия электронного газа почти не зависит от температуры, т. е. тепловое движение почти не изменяет энергию электронов. Поэтому на нагрев электронного газа теплота не затрачивается, что и обнаруживается при измерении теплоемкости металлов.
В состояние, аналогичное обычным газам, электронный газ приходит при температуре порядка тысяч Кельвинов.
Представляя металл как систему, в которой положительные ионы скрепляются посредством свободно движущихся электронов, легко понять природу всех основных свойств металлов: пластичности, ковкости, хорошей теплопроводности и высокой электропроводности.
2. Детали из меди, штампованные в холодном состоянии, имели низкую пластичность. Объясните причину этого явления и укажите, каким способом можно восстановить пластичность? Назначьте режим обработки и приведите характер изменения структуры и свойств.
Ручная ковка была исторически первым из применяемых до сих пор способов формоизменяющей обработки металлов. Первый паровой молот, появившийся в 1843, деформировал металл силой падения груза, а пар служил для поднятия последнего. Вслед за таким молотом простого действия в 1888 появился молот двойного действия, верхняя «баба» которого при движении вниз дополнительно разгоняется силой пара.
Ковка и объемное штампование могут выполняться на молоте или на прессе. Ковка бывает свободная и в штампах. Штампы объемного штампования молотовые и для горячештамповочных прессов состоят из верхней (закрепляемой на верхней головке молота или пресса) и нижней частей, на соприкасающихся поверхностях которых имеются ручьи для последовательного формообразования изделий. Штампы для листового штампования (вырубные, пробивные, гибочные и др.) состоят из двух основных деталей – матрицы и входящего в нее пуансона, а иногда одна и та же часть штампа служит и пуансоном, и матрицей.
3. Вычертите диаграмму состояния железо-цементит, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения для сплава, содержащего 2,7 % углерода. Какова равновесная структура этого сплава при комнатной температуре и как такой сплав называется?
Обычно на диаграмме фазового равновесия системы железо-углерод наносят одновременно систему железо-карбид железа (Fe-Fe3C) – сплошные линии диаграммы – метастабильное равновесие и пунктирные линии – стабильное равновесие Fe-C. В настоящем домашнем задании мы рассматриваем только упрощенную (без перитектического превращения) диаграмму фазового равновесия железо-цементит.
В сплавах системы Fe-Fe3C встречаются следующие фазы: жидкий раствор, твердые растворы на основе различных кристаллических модификаций железа, химическое соединение Fe3C (цементит). На рис.1 представлена диаграмма состояния железо-цементит в фазовом виде.

Рис.1. Фазовая диаграмма состояния железо-цементит
В системе железо-цементит (Fe - Fе3С) имеются следующие фазы: жидкий раствор, твердые растворы - феррит и аустенит, а также химическое соединение - цементит.
Феррит может иметь две модификации - высоко- и низкотемпературную. Высокотемпературная модификация d-Fe и низкотемпературная - a-Fe представляют собой твердые растворы углерода, соответственно, в d- и a- железе.
Аустенит g-Fe - твердый раствор углерода в g-железе. Предельная растворимость углерода в g-железе 2,14%. Он устойчив только при высоких температурах, а с некоторым примесями (Мn, Сг и др.) при обычных (даже низких) температурах. Аустенит обладает высокой пластичностью, низкими пределами текучести и прочности. Твердость аустенита 160...200 НВ.
Цементит Fе3С - химическое соединение железа с углеродом, содержащее 6,67% углерода. Между атомами железа и углерода в цементите действуют металлическая и ковалентная связи. Температура плавления ~1250°С. Цементит является метастабильной фазой; область его гомогенности очень узкая и на диаграмме состояния он изображается вертикалью. Время его устойчивости уменьшается с повышением температуры: при низких температурах он существует бесконечно долго, а при температурах, превышающих 950°С, за несколько часов распадается на железо и графит. Цементит имеет точку Кюри (210°С) и обладает сравнительно высокими твердостью (800 НВ и выше) и хрупкостью. Прочность его i растяжение очень мала (s =40 МПа).
В системе железо - цементит имеются две тонкие механические смеси фаз - эвтектическая (ледебурит) и эвтектоидная (перлит).
Ледебурит является смесью двух фаз g-Fe + Fе3С, образующихся при 1130°С в сплавах, содержащих от 2,0 до 6,67%С, и наблюдается визуально как структурная составляющая железоуглеродистых сплавов, главным образом, чугунов. Ледебурит обладает достаточно высокими прочностью (НВ>600) и хрупкостью.
Перлит (до 2,0%С) представляет собой смесь a-Fe + Fе3С (в легированных сталях -карбидов), образующуюся при 723°С и содержании углерода 0,83% в процессе распада аустенита, и наблюдается визуально как структурная составляющая железоуглеродистых сплавов. Механические свойства перлита зависят от формы и дисперсности частичек цементита (прочность пластинчатого перлита несколько выше, чем зернистого): s=800...900 МПа; d< 16%; НВ 180..,220.
В зависимости от содержания углерода (%) железоуглеродистые сплавы получили следующие названия:
• менее 0,83 - доэвтектоидные стали;
• 0,83 - эвтектоидные стали;
• 0,83...2 - заэвтектоидные стали;
• 2...4,3 - доэвтектические чугуны;
• 4,3...6,67 - заэвтектические чугуны.
Таким образом, сплав, содержащий 2,7 % углерода – это доэвтектический чугун.
4. Вычертите диаграмму изотермического превращения аустенита для эвтектоидной стали, нанесите на нее кривую режима изотермической обработки с выдержкой при температуре 600 оС. Укажите, как этот режим называется, опишите сущность превращений и как такой сплав называется.
На рис. 2 показан верхний участок упрощенной диаграммы Fe-Fe3C.
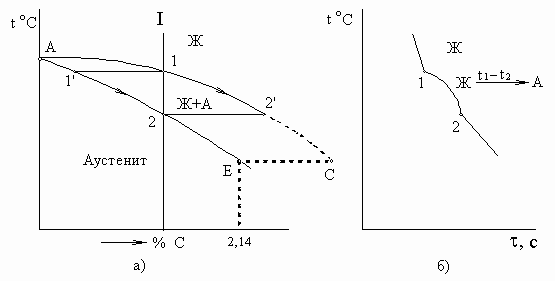
Рис. 2. Верхний левый участок упрощенной диаграммы состояния железо-цементит. а) Первичная кристаллизация сплавов до 2,14 %С (сталей); б) кривая охлаждения сплава 1
В сталях из жидкой фазы кристаллизуется аустенит. Состав жидкой фазы меняется по проекции линии АС на ось концентраций, твердой фазы по проекции линии АЕ.
Превращения в твердом состоянии. Окончательное формирование структуры стали происходит в результате превращений аустенита при дальнейшем охлаждении. Основой этого превращения является полиморфизм, связанный с перегруппировкой атомов из ГЦК решетки аустенита в ОЦК решетку феррита, а также изменение растворимости углерода по линии ES в аустените и PQ в феррите. В сплавах с содержанием от 0,025 до 2,14 %С вторичные превращения начинаются при температурах, соответствующих линиям GS и SE и заканчиваются при температуре ниже 727 оС и линии PSK, в результате эвтектоидной реакции.
