
- •Інструкція з охорони праці в лабораторії хімічного аналізу
- •У разі нещасного випадку негайно звертайтеся до викладача !
- •Практична робота
- •Вимоги щодо виконання практичної роботи
- •Приклад оформлення письмового звіту
- •Завдання до практичної роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Тема 1. Відбір і підготовка проб для аналізу Практична робота
- •Вимоги щодо виконання практичної роботи
- •Завдання до практичної роботи
- •Хід роботи
- •Тема 2. Хімічні реактиви Практична робота
- •Вимоги щодо виконання практичної роботи
- •Інструкція з охорони праці
- •Завдання до практичної роботи
- •Хід роботи
- •Хід роботи
- •Тема 3. Зважування Практична робота
- •Вимоги щодо виконання практичної роботи
- •Завдання до практичної роботи
- •Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Тема 4. Хімічний посуд та допоміжне приладдя Практична робота
- •Вимоги щодо виконання практичної роботи
- •Інструкція з охорони праці
- •Завдання до практичної роботи
- •Хід роботи
- •2.1. Перевірка ємності піпетки на … мл Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •2.2. Перевірка ємності мірної колби на … мл Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •2.3. Калібровка бюретки Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Хід роботи
- •Хід роботи
- •Тема 5. Методи очищення речовин Практична робота
- •Вимоги щодо виконання практичної роботи
- •Інструкція з охорони праці
- •Завдання до практичної роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Хід роботи
- •Тема 6. Обробка осадів Практична робота
- •Вимоги щодо виконання практичної роботи
- •Інструкція з охорони праці
- •Завдання до практичної роботи
- •Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Хід роботи
- •Тема 7. Розчини в об’ємному аналізі Практична робота
- •Вимоги щодо виконання практичної роботи
- •1. Як приготувати 250 мл 0,1 н. Розчину перекристалізованої чистої двоводної щавлевої кислоти (н2с2о4 ˑ 2н2о), яку використовують для титрування лугу? Яку наважку її треба узяти?
- •2. Як приготувати 200 мл 0,05 н. Розчину кМnO4 для титрування методом перманганатометрії?
- •3. Приготувати 1 л 0,2 н. Розчину нСl, використовуючи наявну в лабораторії концентровану нСl з густиною 1,15.
- •Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Хід роботи
- •Вихідні та дослідні дані
- •Обчислення
- •Вихідні та дослідні дані
- •Обчислення
- •4. Перелік навчально-методичної літератури
- •1. Основна
- •2. Додаткова
Вихідні та дослідні дані
т (бюкса) –
Перше вимірювання Друге вимірювання Третє вимірювання
т1 (бюкса з водою) – т2 (бюкса з водою) – т3 (бюкса з водою) –
т1 (води) – т2 (води) – т3 (води) –
тсер. (води) = т1 (води) + т2 (води) + т3 (води) / 3;
Тº С (води) –
ρ (води) –
Обчислення
Фактичну місткість Vфакт піпетки визначають за формулою:
V факт = тсер.(води) / ρ (води), мл
За різницею між фактичним і зазначеним об’ємом посуду визначають поправку А до вказаної на піпетці ємності:
А = Vфактичний – Vзазначений, мл
Висновок:
2.2. Перевірка ємності мірної колби на … мл Хід роботи
1. Добре вимиту мірну колбу висушують струменем теплого повітря і після охолодження зважують на аналітичних або технохімічних вагах з точністю до 0,01 г.
2. Наповнивши колбу до мітки дистильованою водою певної температури, витирають згорнутою в трубку смужкою фільтрувального паперу внутрішні стінки колби вище мітки, після чого ретельно витирають зовні і потім зважують на тих же вагах з такою ж точністю.
3. Різниця результатів обох зважувань відповідає масі води в об’ємі мірної колби. Як і при перевірці піпетки, середню з трьох визначень масу води ділять на масу 1 мл води при даній температурі. У такий спосіб визначають об’єм колби в мілілітрах.
Вихідні та дослідні дані
т (колби) –
Перше вимірювання Друге вимірювання Третє вимірювання
т1 (колби з водою) – т2 (колби з водою) – т3 (колби з водою) –
т1 (води) – т2 (води) – т3 (води) –
тсер. (води) = т1 (води) + т2 (води) + т3 (води) / 3;
Тº С (води) –
ρ (води) –
Обчислення
Фактичну місткість Vфакт. мірної колби визначають за формулою:
Vфакт. = тсер.(води) / ρ (води), мл
За різницею між фактичним і зазначеним об’ємом посуду визначають поправку А до вказаної на колбі місткості:
А = Vфактичний – Vзазначений, мл
Висновок:
2.3. Калібровка бюретки Хід роботи
1. Добре вимиту бюретку заповнюють точно до нульової поділки дистильованою водою відомої температури.
2. У попередньо зважений з точністю до 0,001 г бюкс виливають з бюретки 5 мл води і зважують його.
3. Отриману масу води ділять на її густину при даній температурі (див. табл. 1) і визначають фактичну місткість даної частини бюретки.
4. Так само зважують воду, що поміщається в бюретці в межах від 0 до 10 мл, потім від 0 до 15 мл, від 0 до 20 мл і т.д.
5. Поділивши кожний з отриманих результатів зважування на масу 1 мл води (густину) за даної температури, одержують місткість відповідної частини бюретки, виражену в мілілітрах.
6. На основі отриманих результатів обчислюють поправки для окремих частин бюретки, після чого будують криву поправок для всієї бюретки, причому на вісі абсцис відкладають знайдені поправки, а на вісі ординат – відповідні відліки, за бюреткою в мілілітрах.
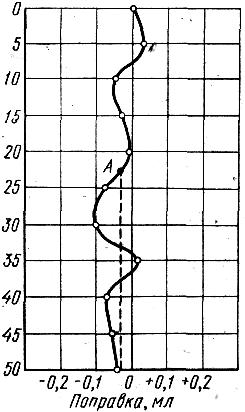
Рис. 1. Крива поправок для бюретки
Приклад. У результаті одного досліду калібровки бюретки за об’ємами 5, 10, 15, 20, 25, 30, 35, 40, 45 і 50 мл були отримані поправки. Після нанесення отриманих даних на вісі координат, отримаємо криву поправок (рис. 1) для даної бюретки. Побудованою кривою користуються в такий спосіб: для того чи іншого об’єму рідини, що витікає з бюретки, знаходять на кривій відповідну точку, наприклад для 22,5 мл це буде точка А; на вісі абсцис цій точці відповідає від’ємна величина 0,035, значить, об’єм рідини, що витікає в дійсності дорівнює 22,5 – 0,035 = 22,465 мл.
