
- •Методичні вказівки
- •1.Короткі теоретичні відомості
- •2.Опис монітора cardiocap II фірми datex
- •4. Медико-технічні характеристики монітору cardiocap II 4.1 Електрокардіограма
- •4.2 Трансторакальна імпедансна респірограма
- •4.3 Температура
- •4.4 Неінвазивний артеріальний тиск
- •4 .5 Інвазивний кров'яни тиск
- •4.6 Пульсоксиметрія SpO2 /Плетизмограма
- •4.10 Загальні дані
- •6. Інструкція та функціональні клавіші cardiocap II
- •6.1 Екг контроль
- •6.2.Плетизмографічний пульс
- •6 .3. Інвазійний кров'яний тиск
- •6.4Внесення змін
- •6.5 Установки
- •6.6. „Гарячі" функціональні клавіші
- •7.Контрольні питання
Міністерство освіти і науки України Вінницький національний технічний університет Інститут радіотехніки, зв'язку та приладобудування Факультет медико-біологічного та електронного приладобудування Кафедра проектування медико-біологічної апаратури
Методичні вказівки
до виконання лабораторної роботи №2
«Дослідження методів пульсоксиметрії і комплексу CARDIOCAPII»
з дисципліни: Сучасні принципи і методи побудови медичних мікрокомп'ютерних систем
Вінниця 2010
Мета роботи: Вивчення та дослідження методів пульсоксиметрії і комплексу CARDIOCAP II фірми DATEX
1.Короткі теоретичні відомості
Кисень необхідний для підтримки усіх фізіологічних функцій організму Відсутність його протягом декількох хвилин приводить до загибелі клітин, а нестача викликає розвиток різних патологій. Тому і виникає необхідність у точному кількісному визначенні вмісту кисню в крові. У даному розділі розглянуті найбільш розповсюджені сучасні методи вирішення цієї проблеми, що ввійшли в повсякденну клінічну практику, датчики на їх основі, а також нові перспективні розробки.
Кисень у крові міститься в двох формах: у розчиненому стані в плазмі й у формі хімічної сполуки з гемоглобіном в еритроцитах. Крива, що відповідає рівноважному співвідношенню цих двох форм, представлена на рис. 1.
Парціальний тиск,кПА
Рис. 1. Залежність між парціальним тиском розчиненого у воді кисню, його об'ємною концентрацією і ступенем насичення гемоглобіна киснем
Ступінь насичення киснем гемоглобіну разом з величиною гематокрита характеризують процес переносу кисню, а градієнт парціального тиску розчиненого кисню, спрямований від кровоносного капіляру до оболонки мітохондрії клітини, визначає ступінь дифузії кисню з крові в клітину.
Необхідно враховувати як нелінійність залежності між ступенем насичення гемоглобіну киснем і парціальним тиском розчиненого кисню (див. рис. 1), так і нестаціонарність кривої (на неї впливають рН крові, температура й інші параметри).
Для визначення парціального тиску кисню крові застосовуються як інвазивні, так і неінвазивні методи. На рис. 2 і 3 представлені схеми двох полярографічних датчиків для інвазивних вимірів. У датчику (рис. 2) у якості електродів використовуються срібні дроти, розміщені в поліетиленовому кожусі, виконаного у вигляді катетера і заповнений рідким електролітом. Кожух має малий діаметр (0,66мм), що дозволяє легко вводити його в артерії дорослих пацієнтів. Датчик, показаний на рис. З, закріплюється на кінці катетера діаметром 1,65 мм і може вводитися в аорту новонародженої дитини через пупочную артерію .У цій
2
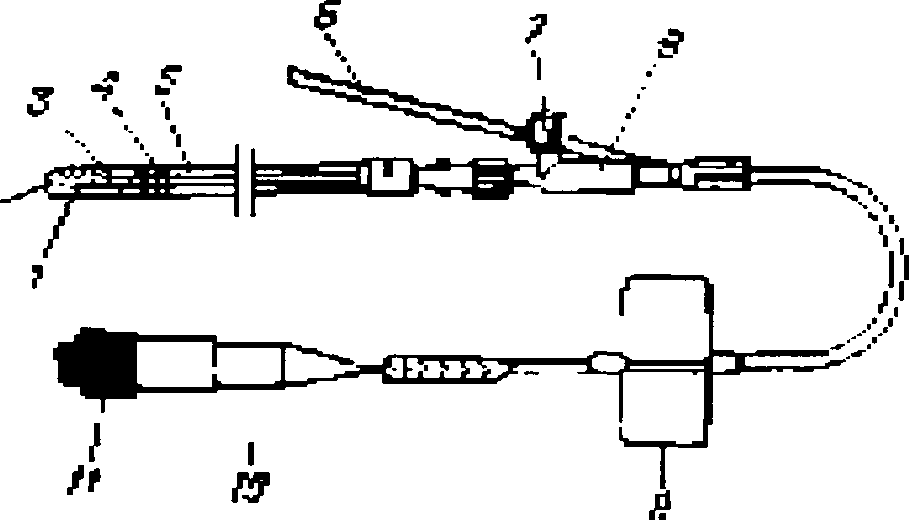
Рис.2. Полярографічний датчик, який вводиться в артерії дорослих пацієнтів:
1 - катод;
2 - електроліт;
3 - анод;
4 - епоксидна смола;
5 - корпус датчика;
6 - гнучка трубка;
7 - штуцер для підключення вимірювача тиску;
8 - фітинг;
9 - фіксуюча лопасть;
10 - заглушка;
11 - запобіжний ковпачок

Рис. 3. Полярографічний датчик, який вводиться в артерії пупка новонароджених дітей.
1 - мембрана і шар кристалів KCl;
2 - шар епоксидної смоли;
3 - провід зі срібла;
4 - анод;
5 - катод;
6 - епоксидна смола;
7 - катетер з полівінілхлориду;
8 - вхідний отвір для проби.
Найбільш перспективним з методів, що розвиваються, є оптичний флуоресцентний метод з використанням волоконно-оптичних світловодів. Використовується властивість кисню гасити флюоресценцію деяких флюорофорів, зменшуючи інтенсивність збудженого випромінювання. Флуоресцентний барвник іммобілізований на пористій полімерній підкладці, покритий проникною для газу мембраною і розташований на кінці катетера. Для підведення збуджуючого випромінювання (довжина хвилі 468 нм) і відводу флуоресцентного випромінювання (довжина хвилі 514 нм) використовуються волоконні світловоди.
Конструкції оптичних датчиків відрізняються простотою, однак по стабільності і терміну служби вони поступаються електрохімічним датчикам.
Існують також методи визначення парціального тиску in vitro - це в основному електрохімічні й оптичні методи. Прикладом електрохімічного датчика для вимірів in vitro служить пристрій, створений фірмою Biologikal Engeneering Co. (США). Полярографічний датчик має вимірювальний електрод Кларка, до якого кисень дифундує через газопроникну мембрану. Мембрана кріпиться за допомогою стерильного замінного з'єднувача, що дозволяє легко видаляти датчик для проведення калібрування. Вбудований термістор служить для компенсації температурних коливань крові, що аналізується, і навколишнього середовища.
Для вимірів in vitro служить також датчик фірми Radiometer (США). заснований на ефекті гасіння флюоресценції. Цей пристрій має чутливий елемент у вигляді тонкої полімерної плівки з нанесеним на неї барвником, поміщеної в замінний кожух.
Неінвазивні методи виміру більш перспективні, чим інвазивні. Пристрій неінвазивного транскутанного датчика для виміру парціального тиску кисню, розчиненого в крові, показаний на рис. 4. Дня аналізу досить притиснути такий датчик до поверхні шкіри. Чутливим елементом приладу є полярографічний електрод. Для підвищення чутливості виміру необхідне локальне нагрівання шкіри. Нагрівання доцільне по наступним причинах: по-перше, він викликає розширення капілярів, що приводить до збільшення їх поверхні і припливу крові, по-друге, при зростанні температури крива, показана на рис. 1, зміщується вправо, тобто у плазму крові виділяється додаткова кількість кисню; по-третє, полегшується процес дифузії кисню через шкіру до датчика.
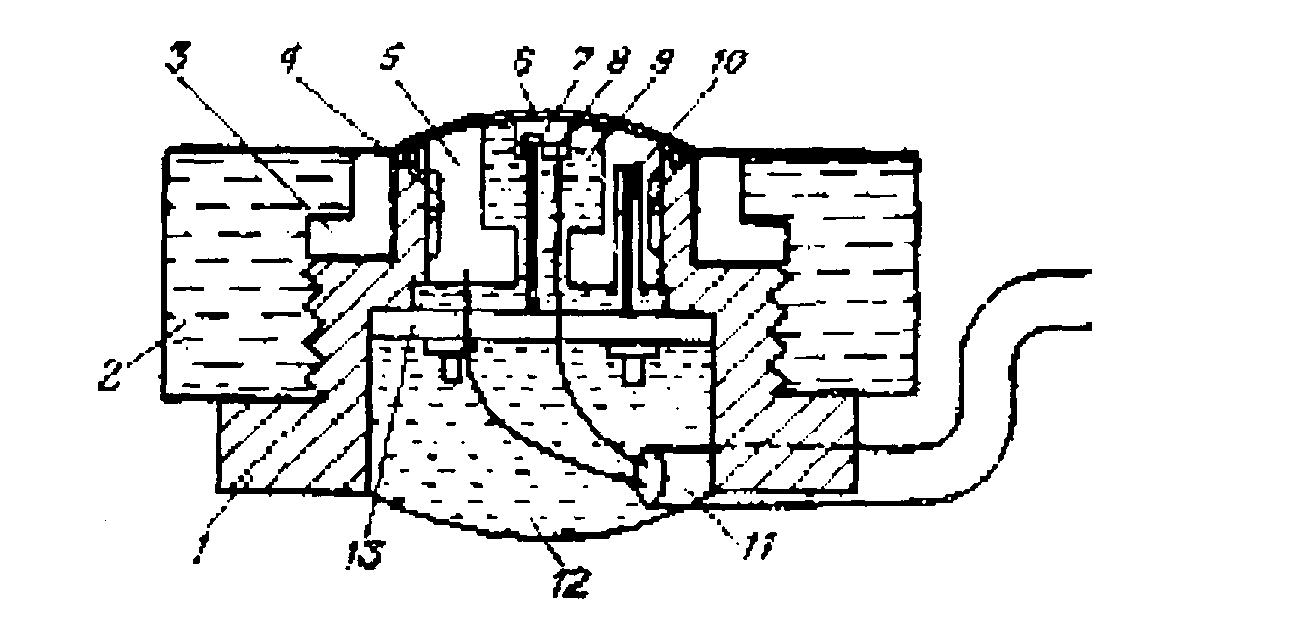
Рис. 4. Транскутанний датчик:
1 - корпус датчика;
2 - гвинт кріплення ;
3 - кільце для закріплення мембрани;
4 - нагрівальний елемент;
5 - анод;
6 - мембрана;
7 - термістор, що вимірює температуру крові в капілярах;
8 - катод;
9 - камера з електролітом;
10 - контрольний термістор;
11 - кабель;
12 - епоксидна смола;
13 - з'єднувальний щиток
При дослідженнях новонароджених дітей з використанням нагрівання поверхні шкіри до 43 °С зменшення значення вимірюваного парціального тиску, викликане процесом дифузії кисню від епідерми до поверхні шкіри, цілком компенсується впливом перерахованих вище трьох факторів. У цьому випадку показання приладу будуть строго відповідати парціальному тиску кисню в артеріальній крові. Однак при такій температурі необхідно періодично відключати підігрів щоб уникнути опіку шкіри.
У дорослих пацієнтів унаслідок менш інтенсивного розширення судин і більшої товщини шкіри навіть при нагріванні поверхні до 44 °С (максимально допустима температура) виміряне значення парціального тиску істотно нижче, ніж дійсне. Подавлення поверхневого обміну речовин на ділянці шкіри, з яким контактує датчик, усуває цю невідповідність. Так, досвіди, проведені з ціанідом калію в якості інгібітору, дали гарні результати при місцевому нагріванні шкіри усього до 39 °С. Однак ціанід калію непридатний для використання в клінічній практиці через його високу токсичність. Фахівці вважають за доцільне провести дослідження по створенню інших інгібіторів.
Іншим підходом до транскутанного визначення парціального тиску кисню в крові є створення датчика спеціальної конструкції, що дозволяє проводити виміру на тих ділянках тіла, де відповідність показання приладу дійсній величині парціального тиску кисню в артеріальній крові досягається без застосування локального нагрівання шкіри (наприклад, на кон'юнктиві, судини якої живлять киснем роговицю в періоди, коли око закрите). Один з варіантів конструкції такого датчика представлений на рис. 5. Мініатюрний кисневий електрод розташований на пластиковому кільці, що закріплюється на повіці пацієнта.
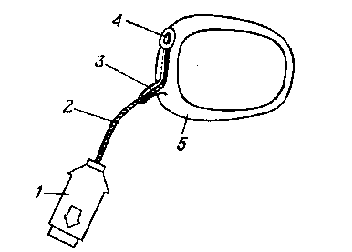
Рис.5. Датчик для вимірювання на кон'юктиві:
1 - з'єднувач;
2 - кабель;
3 - направляючий патрубок;
4 - чутливий елемент (кисневий електрод);
5- кільце із поліметилметакрилату, що притискується до кон'юктиви
Для визначення ступеня насичення гемоглобіну киснем звичайно застосовується оптичний метод, заснований на розходженні спектрів поглинання оксигенованого і неоксигенованого гемоглобіну. Основними джерелами похибок при цьому методі є розсіювання випромінювання і наявність у крові різних форм гемоглобіну, що спотворюють спектр поглинання. Велика частина таких форм присутня в малих кількостях (менш 5 %), але концентрація карбоксигемоглобіна, особливо в курців, досягає 15-20 %.
Похибка, викликана розсіюванням випромінювання, може бути легко скоректована шляхом введення відповідної поправки у величину коефіцієнта абсорбції, закладену в пам'ять керуючого процесора.
Так само, як і парціальний тиск кисню в крові, ступінь насичення гемоглобіну киснем може вимірюватися інвазивними і неінвазивними методами. Інвазивні методи почали активно розвиватися зі створенням волоконно-оптичних катетерів. Похибка, пов'язана з відбиванням випромінювання від стінок судин, усувається в оптичних датчиках шляхом використання пробного випромінювання з двома різними довжинами хвиль і введення мікропроцесорної техніки для обробки результатів. В якості джерел випромінювання в датчиках використовуються світловипромінюючі діоди.
Визначення ступеня насичення гемоглобіну киснем in vitro застосовувалося вже на самих ранніх стадіях розвитку кардіохірурії Сучасні пристрої цього типу використовують проточні оптичні комірки, у які вводиться пробне випромінювання. Виміри здійснюються на трьох різних довжинах хвиль. Такі прилади визначають звичайно одночасно ступінь насичення гемоглобіну киснем з похибкою біля ±2 % і величину гематокриту.
Неінвазивні датчики усе більш витісняють інвазивні на світовому ринку. Принцип дії їх заснований на просвічуванні тканини (наприклад, кінчика пальця) випромінюванням різних довжин хвиль для виключення похибки, що виникає внаслідок різного кольору шкіри в пацієнтів. Один із приладів, що випускаються промисловістю, має вбудоване джерело випромінювання, оснащене обертовим колесом з 8 оптичними фільтрами. Пучок світловодів. що підводить випромінювання до кінчика пальця або вушної раковини пацієнта, дуже громіздкий. Похибка виміру такого приладу ±3 %. Так як обсяг крові в тканинах періодично змінюється при кожному серцевому скороченні, при вимірах виникають відповідні флуктуації інтенсивності пропускаємого випромінювання, виходячи з яких можливе визначення цим же приладом частоти серцебиття пацієнта.
В області неінвазивних вимірів ступеня насичення гемоглобіну киснем найбільш значним винаходом є пульсаційний оксиметр. При просвічуванні ділянки тканини випромінювання поглинається самою тканиною, гемоглобіном венозної й артеріальної крові. Пульсаційний прилад оснований на тому ж ефекті флуктуації об'єму крові в тканинах, що при визначенні частоти серцебиття багатохвилевим приладом для неінвазивних вимірів. Так як пульсація об'єму і, відповідно, інтенсивності, пропущеного випромінювання виникає тільки в артеріальних судинах, вимір флуктуації сигналів, отриманих на двох довжинах хвиль, з наступною обробкою дасть інформацію про ступінь насичення киснем гемоглобіну артеріальної крові.
Основними перевагами пульсаційного оксиметра є простота експлуатації і порівняно невисока вартість. Крім того, не потрібне ні нагрівання поверхні шкіри, ні місцеве подавлення поверхневого обміну речовин. В якості джерел випромінювання використовуються два світловипромінюючих діоди з довжинами хвиль 660 і 940 нм, в якості детектора - напівпровідниковий фотодіод. Ці елементи мініатюрні і недорогі.
Парціальний тиск розчиненого кисню і ступінь насичення киснем гемоглобіну - це тільки непрямі показники загального кисневого обміну організму. Так як кисень дифундує до мітохондрій клітин через стінки капілярів, часто виникає необхідність визначення вмісту кисню безпосередньо в капілярній крові чи у мембранах мітохондрій. При порушенні рівномірного постачання тканин киснем необхідно знати, як розподіляється розчинений і зв'язаний з гемоглобіном кисень в організмі, і провести аналіз картини розподілу. Для таких досліджень у даний час розробляються прилади на основі методів ядерного
магнітного резонансу (ЯМР). Отримані цими методами сигнали від атомів фосфору 31Р дають інформацію про концентрації в міжклітинних просторах речовин, що беруть участь у кисневому обміні (наприклад, аденозинтрифосфата, фосфокреатину, неорганічних фосфатів). Знаючи константи реакцій кисневого обміну можна визначити загальну картину кисневого обміну).
Іншим підходом до рішення поставленої проблеми є введення в організм речовини - маркера, наприклад, емульсії перфлюорокарбона. Атоми 19F цього з'єднання легко детектуються методом ЯМР, а так як молекули кисню мають парамагнітні властивості, час спін-решіткової релаксації атомів 19F однозначно зв'язаний зі вмістом кисню.
Істотним недоліком методів ЯМР є висока вартість устаткування, що стримує впровадження таких приладів у широку клінічну практику.
Для одержання картини розподілу кисню в організмі придатний також метод інфрачервоної спектроскопії. Інфрачервоне випромінювання з довжинами хвиль, від 700 до 1200 нм здатне просвічувати наскрізь м'язові тканини товщиною 6-7 см. Метод успішно був використаний при дослідженні кисневого обміну і циркуляції потоків крові мозку недоношених дітей.
Так як довжина оптичного шляху випромінювання в тканинах невідома, кількісна оцінка результатів ІЧ-спектроскопії представляє труднощі. Ця проблема частково вирішується непрямими методами» наприклад шляхом калібрування пристрою з використанням порівняння отриманих результатів з даними досліджень іншими методами. Останні розробки дозволили визначити довжину оптичного шляху випромінювання за допомогою вимірювання часу проходження ультракороткого (4 пс) світлового імпульсу через тканину
Робота пульсового оксиметра основана на законі Ламберта-Бера, що визначає інтенсивність світла, яке пройшло через об'єкт, як функцію початкової інтенсивності світла, товщини об'єкту, концентраційного й абсорбційного коефіцієнтів ділянок досліджуваної живої тканини і визначає процес вимірювання сатурації як реєстрацію амплітуди сигналів різних довжин хвиль.
Розглянемо процес вимірювання сатурації артеріальної крові киснем, зокрема, двоспектральний метод. Сатурація артеріальної крові визначається з виразу:
SpO2 = HbO2 / THb (1)
де : Нb2- концентрація оксигемоглобіну;
THb - загальний вміст гемоглобіну.
Насичення артеріальної крові, що визначається виразом (1), отримало назву фракційного насичення крові киснем.
Відомо, що до складу THb, окрім HbO2 і HbR (відповідно окисленого і відновленого гемоглобіну), входять також такі компоненти, як СоНb (карбоксигемоглобш) і MetНb (метгемоглобін). На рисунку 6 показано спектри поглинання різних компонентів гемоглобіну.
Вивчаючи ці спектри, можна зробити висновок, що на довжинах хвиль 640 нм (червоне світло) та 960 нм (і більше) різниця між коефіцієнтами поглинання HbO2 і HbR максимальна і різна за знаком, крім того, на цих довжинах хвиль вплив складових MetНb і СоНb буде мінімальним, що практично дозволяє не зважати на них [4]. Зроблений висновок створює передумови для вибору елементної бази при розробці приймальної частини ПО, яка працює на основі методики двоспектрального методу.
Рис. 6. Спектри поглинання різних компонент гемоглобіну
Оскільки сумарна абсорбція суміші речовин визначається як сума абсорбцій окремих компонентів, то модель об'єкта дослідження при вимірюванні величини SpO2 можна подати як сумарне поглинання світла на кожній довжині хвилі тільки компонентами HbR, HbO2 і тканинами. В тканинах міститься червоний мускульний пігмент - міоглобін MНb, що частково стає оксигемоглобіном (MetНb) за рахунок постачання тканин киснем шляхом десатурації HbO2 у капілярах. З врахуванням того, що розглянутий вище двоспектральний метод, який застосовується в ПО, не розрізняє за спектральними характеристиками HbO2 і MetНb, а сам оксимюглобін запасається в тканинах шляхом десатурації HbO2, то практично сатурацію SpO2 визначають за формулою:
SpO2 = HbO2 / ( HbO2 + HbR) • 100%. ( 2)
Це насичення отримало назву функціонального насичення крові киснем. Система обробки інформації в більшості розроблених ПО ( приймальна частина яких працює за методикою двоспектрального методу) призначена для обчислення коефіцієнта R:
R =( АС1 / DC1 ) : (АС2 / DC2) (3)
де : АС - змінна складова вимірюваних сигналів;
DC- постійна складова вимірюваних сигналів; індекси 1 і 2 відносяться до інтенсивностей сигналів, відповідно виміряних в червоній і інфрачервоній областях спектра;
R - відношення коефіцієнтів модуляції ( К1 = АС1 / DC1 і К2 = АС2 / DC2
Двох спектральних діапазонах. Встановлена теоретична і експериментальна залежність між величиною 5р02 (сатурація артеріальної крові) і коефіцієнтом Я (5р02=ДЯ)), як правило подається у вигляді таблиці або у вигляді графіка, який отримав назв\градуювальної або тарувальної характеристики.Пульсові оксиметри, що працюють за вище вказаним алгоритмом є досить дорогими, оскільки вимагають використання мікропроцесора та значного об'єму оперативної пам'яті для відповідної обробки інформації. Більшість лікарень не можуть собі дозволити придбати такий прилад, тому виникає необхідність розробки більш спрощеного, але в достатній мірі точного пульсоксиметра.
Точність ПО (1.5% при сатурації 90% і вище ) не дозволяє оцінити рО2.При цих значеннях невеликі зміни насичення (1-2%) відбуваються при значних коливаннях раО2 ( 10-20 мм. рт. ст.). Ця проблема особливо важлива для новонароджених з високим вмістом в крові фетгемоглобіну. Таким чином сатурація, що вимірюється ПО, може бути менше 100% при значенні рО2 вищеь 90 мм. рт. ст. Це особливо стосується недоношених дітей, в яких кліткові мембрани еритроцитів пошкоджуються при гіпероксії вільними радикалами. В той же час при клінічно прийнятних значеннях може бути достатньо низьке значення р02 ( при підвищенні легеневого судинного опору). Таким чином, відсутність кореляції між р02 і сатурацією при значеннях останньої нижче 88-85% і вище 95-97% не дозволяє робити висновки про адекватність постачання дитячого організму киснем .
Отже, для підвищення точності отримання результатів, виникає необхідність в розробці нових методів оцінки сатурації крові киснем, що вимірюється пульсовим оксиметром.
Суть таких методів полягає в наступному:
1) проводиться моделювання і вибір одного із варіантів конструкції приймальної частини (датчиків) пульсового оксиметра, наприклад, використання одночасно двох датчиків, які б працювали "на просвічування " і "на відбиття";
2) забезпечується використання датчиків, які б працювали на кількох довжинах хвиль (наприклад λ1=660 нм , λ2 =810 нм , λз=960нм ).
3) розробляється новий алгоритм обробки результатів з використанням мікроконтролера (аналогів КР1816ВЕ51, АТ89С51).
Р озглянемо
спочатку конструкції датчиків.
озглянемо
спочатку конструкції датчиків.
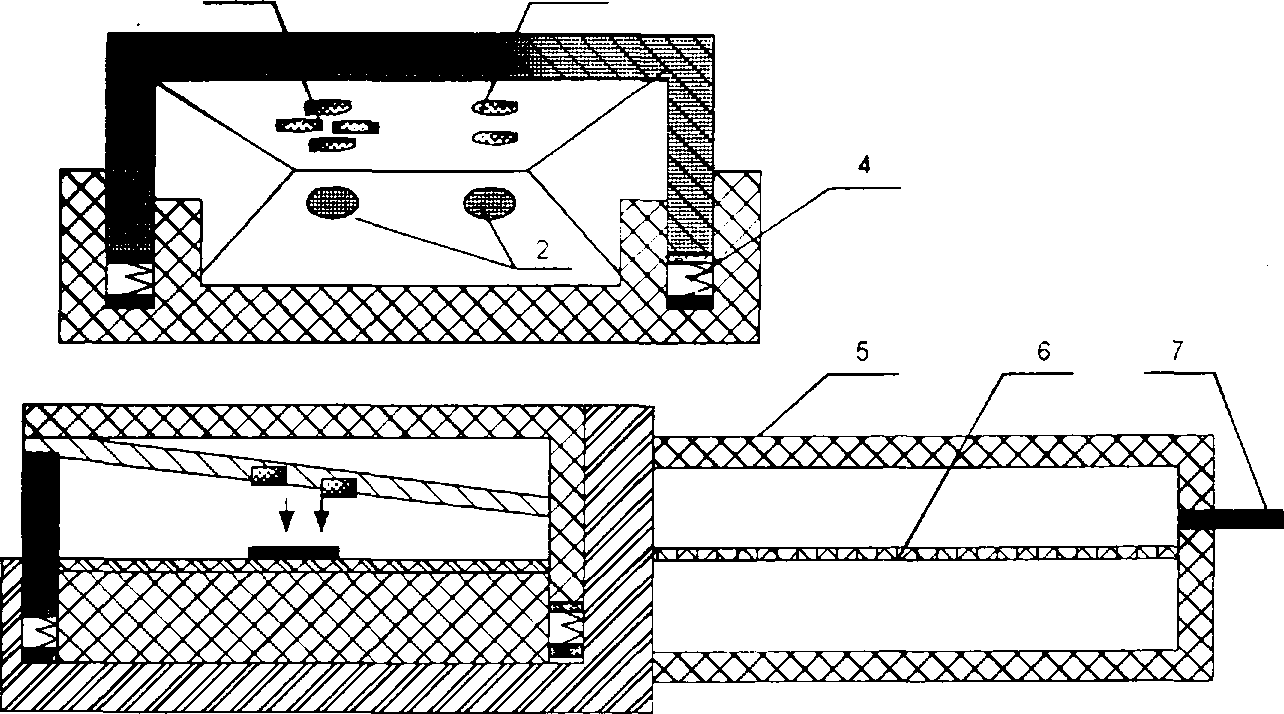
В запропонованому на рис. 7 варіанті конструкції, прогнозуються високі показники якості усіх необхідних параметрів: захист від зовнішнього освітлення та зменшення впливу змінної складової мережі живлення, точність вимірювання, зручність в користуванні. До недоліків даного підходу слід віднести відносну важкість задания режимів роботи датчика та обробки результатів (що впливатиме на швидкість відображення результату), тому пропонується остаточний варіант конструкції трансмісійного датчика, яким буде обладнано розроблюваний в даній роботі пульсоксиметр. Остаточний варіант конструкції показано на рис.8.
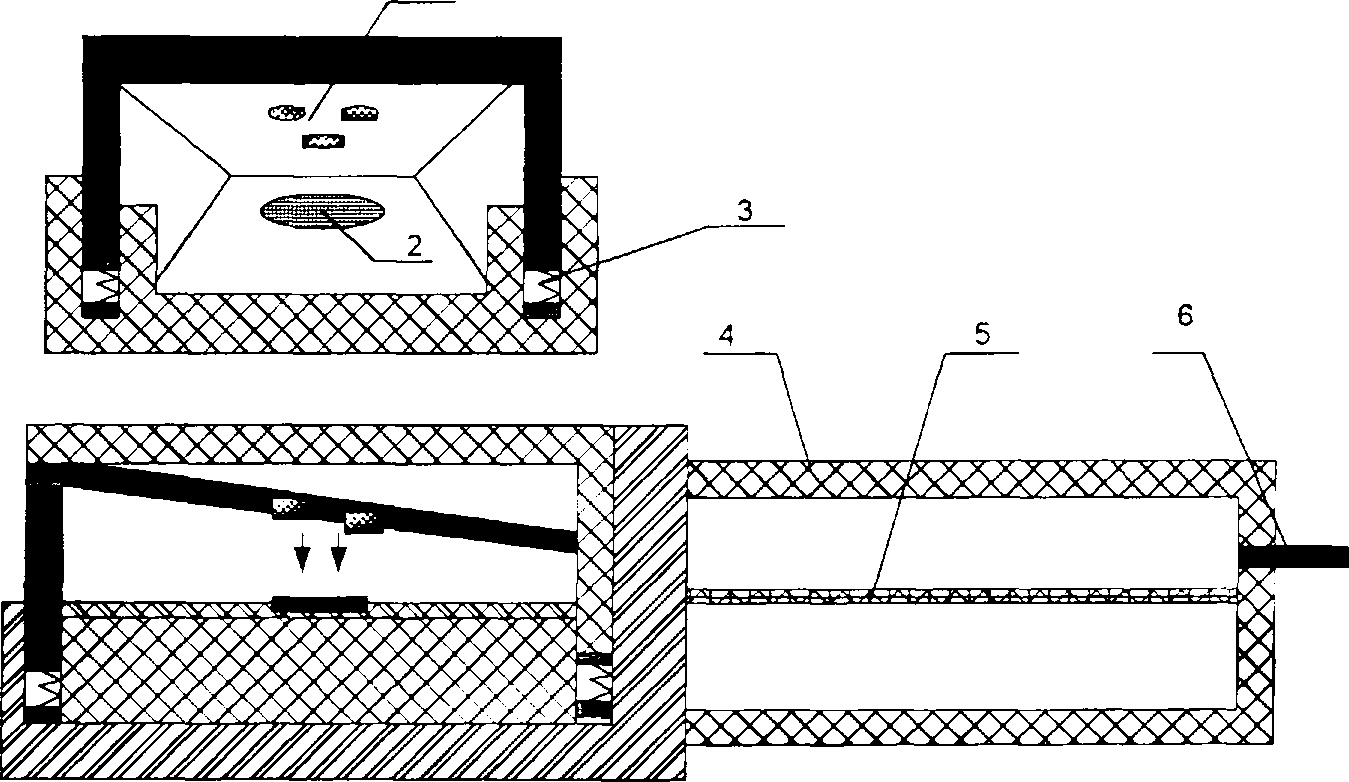
Рис. 8 - Остаточний варіант конструкції пальцевого трансмісійного датчика
1 - випромінювачі (червоний, два інфрачервоних );
2 - фотоприймач,
З - пружня пластина;
4 - корпус;
5 - плата підсилювача;
6 -кабель.
При використанні датчика, показаного на рис. 8, слід поміщати лише один палець на робочу зону. Алгоритм обробки результатів значно спроститься, оскільки тут використано три випромінювачі і лише один фотоприймач. Кожен випромінювач відповідатиме за подальшу реєстрацію відповідної складової гемоглобіну:
червоний світлодіод, що має довжину хвилі в максимумі спектральної смуги λ1=660 нм, відповідатиме за подальшу реєстрацію оксигемоглобіну;
інфрачервоний світлодіод, що має довжину хвилі в максимумі спектральної смуги λ2= 805 нм, відповідатиме за подальшу реєстрацію загального гемоглобіну;
інфрачервоним світлодіодом, що має довжину хвилі в максимумі спектральної смуги λ3=960 нм, відповідатиме за подальшу реєстрацію відновленого гемоглобіну; Отже, розроблений варіант конструкції трансмісійного датчика може бути використаний в розроблюваному пульсовому оксиметрі. Єлиною проблемою, що може виникнути при виготовленні даного датчика може бути проблема, пов'язана з підбором випромінювача, що має довжину хвилі в максимумі спектральної смуги λ1=805 нм. Відомо, що навіть технологічно виготовити такий елемент дуже важко, бо немає такого спеціального матеріалу.
Але для щоб вирішити цю проблему необхідно підібрати такий випромінювальний елемент згідно, що має довжину хвилі в максимумі спектральної смуги близьку до λ2 = 805 нм, наприклад λ1=810 нм.
Враховуючи деякі особливості вище розробленого датчика (кількість випромінювачів і фотоприймачів, а також алгоритм обробки інформації) наведемо кілька варіантів конструкції транскутанного датчика, тобто такого, що працює по схемі "на відбивання", в відповідності з якою первинний пучок світла вводиться в тканину в одному місці шкіри, а після багатократних розсіювань на оптичних неоднорідностях тканини дифузно відбитий від неї береться з іншого місця тканини. Середньостатистична довжина шляху світла в тканині визначається відстанню від місця входу в тканину до місця виходу з неї. Цю відстань можна задавати відповідною конструкцією оптичного датчика. Тоді довжина шляху світла в тканині фіксована , і результат вимірювання залежить тільки від вмісту оксигемоглобіну.
Один з варіантів конструкції транскутанного датчика показаний на рисунку 9. Датчик передбачається оснащити шістьма випромінювачами, подібно до того як це зроблено в конструкції трансмісійного датчика, показаного на рисунку 7, але випромінювачі буде розміщено по колу на певній відстані від центру, що визначатиме середньостатистичну довжину шляху світла. Оптимізація вище згаданої відстані проводиться в наступних розділах даної роботи. Дана конструкція має велику зручність у користуванні, хороший захист від впливу зовнішнього світла (завдяки розміщенню фотоприймача на певній відстані від краю в глибину конструкції)
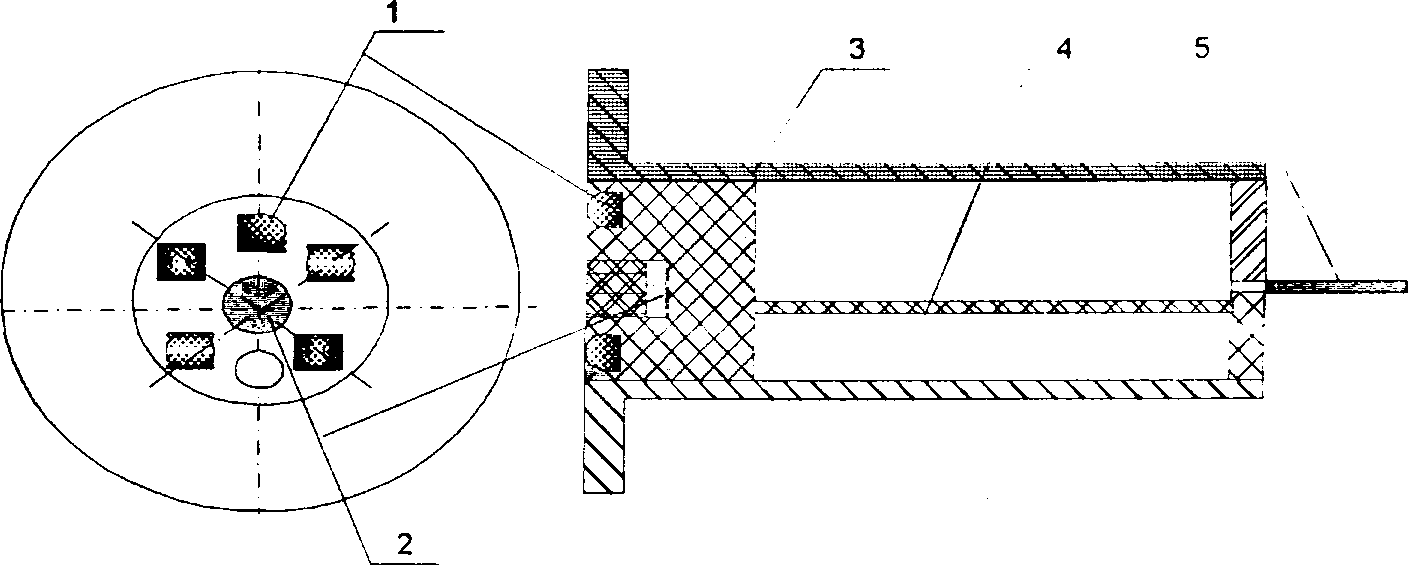
Рис.9. Конструкція транскутанного датчика.
1-випромінювачі;
2-фотоприймач;
3-корпус;
4-плата підсилювача;
5-кабель.
Ще одна можлива модифікація транскутанного датчика показана на рис 10. Тут передбачається використання восьми випромінювачів(три зелених, три синіх, один червоний, один інфрачервоний) та двох фотоприймачів, і, при цьому вони розділені на дві частини. Це пов'язано з тим, що таким чином буде легше оптимізувати величину середньостатистичного шляху світла, тобто змінювати відстань між центром та місцем розташування випромінювача. Переваги даної конструкції полягають у тому, що з допомогою такого датчика можна тривалий час відслідковувати сатурацію крові киснем, прикріпивши датчик на певній ділянці шкіри.
Р
исунок 10 - Конструкція подвійного транскутанного датчика.
1 випромінювачі (три синіх, три зелених);
2 -фотоприймачі;
З -випромінювачі (один червоний, один інфрачервоний ); 4 - корпус ,
5 - плата підсилювача;
6 - кабель.
Оскільки передбачається, що до розроблюваного приладу буде можливість підключати або транскутанний або трансмісійний датчик, то при розробці транскутанного датчика слід використати ту ж саму кількість випромінювачів тафотоприймачів (що і в трансмісійного), а також залишити той же самий алгоритмобробки результатів. Тому на рис. 11 показано остаточний варіант конструкції транскутанного датчика.
Рис. 11. Остаточний вapiaнт транскутанного датчика.
1 - випромінювачі (один червоний, два інфрачервоних );
2 -фотоприймач,
3 - корпус ;
4 -плата підсилювача;
5 - кабель;
lс - відстань від випроміювачів до джерела;
Df- величина заглиблення фотоприймача.
Слід звернути увагу на те, що блок підсилювача прийнятих сигналів розташований в корпусі датчика, що значно підвищує завадостійкість і дозволяє в значній мірі виключити вплив складової 50 Гц мережі живлення.
Вибір випромінювачів, що працюють на довжинах хвиль λ1|=660 нм λ2=810 нм, λ3=960 нм, пояснюється поглинальними властивостями компонентів гемоглобіну (рис. 1). Випромінювач з довжиною хвилі λ2=810 нм вибраний виходячи з міркувань про те, що в області λ =810 нм існує так звана ізобестична точка в якій показники поглинання окисленого і редукованого гемоглобіну однакові.
Розроблений пульсовий оксиметр дозволяє також вимірювати пульс, що показано на рис. 12
.t, MC
Рис. 12. Вимірювання періоду T що відповідає періоду серцевих скорочень. 1 - сигнал на виході фотодіода;
2 - сигнал на виході підсилювача;
З - сигнал на виході тригера Шмітта; Т-період серцевих скорочень.
Вимірювання періоду Т мікропроцесором здійснюється програмно завдяки вбудованому таймеру-лічильнику. Як тільки виміряно період Т, то одразу після приходу наступної пульсової хвилі вмикаються випромінювачі (почергово, з частотою 100 Гц), і фіксується та оцифровується величина напруги, що надходить від кожного з випромінювачів. Позначимо напруги таким чином
U0 - напруга, при не ввімкнених випромінювачах (коли у фотоприймачу роходить так званий темновий струм);
UR2 - напруга, виміряна при ввімкнені червоного (Red) випромінювача (λ =640 нм);
UIR1 - напруга, виміряна при ввімкнені інфрачервоного (IRed) випромінювача (λ =810 нм);
UIR2 - напруга, виміряна при ввімкнені інфрачервоного (IRed)
випромінювача (λ=940 нм); Таким чином, згідно аналізу поглинальних властивостей похідних гемоглобіну, можна визначити напруги, завдяки яким можна обчислити рівень сатурації:
U1 = UR – U0 , яка пропорційна вмісту редукованого гемоглобіну HbR. тобто HbR=f(U0;
U2 = UIR1 – U0 , яка пропорційна вмісту редукованого гемоглобіну HbR та оксигемоглобіну HbО2 , тобто (HbR+ HbО2)=f(U2);
3) U3 = UIR2 – U0 , яка пропорційна вмісту оксигемоглобіну HbО2 тобто Hb02=f(U3);
Звичайно, напруги U1 , U2 , U3 необхідно пронормувати і дані занести в пам'ять мікропроцесора. В даному підході пропонується визначати сатурацію Sp О2 по функціональному насиченню, тобто: SpО2 = HbО2 / ( HbО2+HbR).
Схематично визначені напруги можна показати у вигляді діаграми (рис
13).
Як видно з діаграми величини U2 та U3 мало відрізняються, тому пропонується визначати напругу U3 (яка відповідатиме за вміст HbО2) наступним чином:
U//3=( U2 - U1 + U3)/2
Тоді формула для визначення сатурації матиме вигляд:
SpО2= f (U//3 / ( U2+ U//3))
Але в зв'язку з тим, що можуть виникнути певні проблеми при виконанні операцій з плаваючою точкою, пропонується брати величину, обернену до співвідношення між напругами, тобто:
SpО2= f ((U2 + U//3 )/ U//3 (6)
Після обчислення сатурації на дисплей виводиться результат про величин) частоти пульсу та сатурацію.
Очевидно, що згідно формули (6) обчислюється лише певний коефіцієнт, і, для того щоб цей коефіцієнт набув фізичного змісту, тобто відповідав величині SpО2 (%) необхідно його пронормувати. В розробленому пульсовому оксиметрі варіації величин вище згаданого коефіцієнту, пронормовано таким чином, що вони відповідають сатурації в межах від 40 до 100%. Тарувальну характеристику пропонується знімати наступним чином.
Фізично здоровій людині (пацієнту 18-20 років) необхідно дати подихати чистим киснем напротязі 5 хв;
Накласти манжету на плечеву кістку, створити тиск 200 мм.рт.ст. і потім, нижче місця накладання манжети провести вимірювання величини SpО2 за допомогою зразкового пульсового оксиметра, і, в цей же момент часу провести вимірювання з допомогою розробленого ПО. Очевидно, що з допомогою запропонованого методу буде обчислено лише коефіцієнт відношення виміряних напруг при ввімкненні кожного з випромінювачів, тому необхідно знайти функціональну залежність між виміряним SpО2 (з допомогою зразкового ПО) і коефіцієнтом співвідношення між напругами (див. формулу (6)) .
При першому вимірюванні сатурація становитиме 100% (високий рівень), а при останньому замірюванні, що необхідно провести не пізніше ніж через 3 хвилини, сатурація становитиме 40% (низький рівень).
Отже, в таблицю ( розміщена в пам'яті мікропроцесора )слід занести 60 значень (розрахованих згідно (6)), що відповідатимуть сатурації в межах від 40 до100 %.
