
Амперометрическое титрование с двумя индикаторными электродами.
Стандартизация раствора тиосульфата натрия по бихромату калия. Тит-ровать тиосульфат непосредственно K2Cr2O7 нельзя, так как он реагирует со всеми сильными окислителями (бихромат, перманганат, бромат и т. п.) нестехиометрично. Применяем метод замещения, вначале используя стехиометрическую реакцию между бихроматом и иодидом:
Cr2O72– + 6I– + 14H+ → 3I2 + 2Cr3+ + 7H2O.
I2, выделившийся в эквивалентном дихромату количестве, оттитровываем стандартным раствором тиосульфата:
2S2O32– + I2 → S4O62– + 2I–.
Для протекания первой реакции необходима высокая концентрация протонов (для повышения потенциала системы Сr2O72–/2Сr3+), большой избыток иодида (для понижения потенциала системы I3–/3I– и для растворения выделяющегося иода), а также время, т. к. скорость реакции невелика. Вторая реакция протекает быстрее, чем реакция тиосульфат-ионов с протонами:
2H+ + S2О32– = H2O + SO2 + S,
Перед титрованием иода нужно понизить кислотность раствора разбавлением водой.
Электрохимические реакции протекающие на Pt-электроде:
I2 + 2e– → 2I‾ (на катоде),
2I‾ – 2e– → I2 (на аноде).
В данном случае обратимая система I2/2I‾ титруется необратимой системой 2S2O32–/S4O62– . В ходе титрования ток сначала возрастает и достигает максимального значения при равенстве концентраций окисленной и восстановленной форм иода в растворе (при 50 % оттитровывания). При дальнейшем титровании содержание I2 в растворе становится значительно меньше, чем I‾, ток в цепи уменьшается и достигает нулевого значения в точке эквивалентности. При дальнейшем прибавлении титранта ток не изменяется, поскольку окислительно-восстановительная пара титранта необратима.
В стакан для титрования на 100 мл вносим мерным цилиндром 5 мл 2 н H2SO4, 10 мл 10 %-го раствора KI и при помощи пипетки 5,0 мл стандартного раствора K2Cr2O7. Для завершения реакции оставляtv смесь на 3-5 мин в темноте, прикрыв часовым стеклом. Затем в стакан добавляем 50 мл H2O (дист.) и погружаем электроды.
Нажимаем на панели управления ПК кнопку «Установки» → «Текущие установки – Устройства» включаем мешалку и устанавливаем слайдером интенсивность перемешивания в положение – 5. Активируем источник напряжения для генераторной цепи и напротив метки «Значение [В]» устанавливаем постоянный потенциал «0,05 В» и выбираем параметр регистрации для генераторной цепи – «Ток ± 100 мкА».
Источник тока в генераторной цепи и источник напряжения в индикаторной цепи должны быть дезактивированы. В диалоговом окне «Текущие установки – Дополнительные параметры» задаем следующие установки:
Автоматическая остановка измерений по параметру «Время» – 30с (время, необходимое для установления равновесия химической и электрохимической реакций);
период регистрации значений – 1 с;
«Приливаемый объем титранта [мл]» – 0.
На панели управления активируют кнопку «Старт».
После установления регистрируемого параметра тока происходит автоматическая остановка измерения и мешалка отключается.
Получаем первую точку титрования и величину регистрируемого параметра – I, когда объем добавленного титранта равен нулю. Снова открываем диалоговое окно и задаем значение приливаемого объема равное 0,5 мл. Добавляем при помощи бюретки 0,5 мл раствора K2Cr2O7 и нажимаем кнопку «Продолжить». Получаем вторую точка точку титрования.
Продолжают титрование с шагом 0,5 мл, регистрируя величины силы тока после добавления каждой порции титранта. Титрование продолжают до достижения тока нулевых значений. Результаты записывают в «Архив», а численные значения величины силы тока и объема титранта заносим в таблицу. Строим кривую титрования в координатах I от V(Na2S2O3).
Рассчитываем концентрацию раствора тиосульфата натрия по формуле:
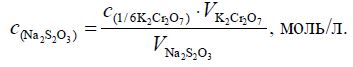
Рассчитываем стандартное отклонение среднего и доверительный интервал.
Вывод:
Определение иода в иодсодержащих медицинских препаратах. В стакан для титрования на 100 мл при помощи пипетки вносят 1,0 мл спиртового 5 %-ного раствора I2, 50 мл H2O (дист.) и мерным цилиндром 5 мл 2 н H2SO4. Погружаем электроды и нажимаем на панели управления ПК кнопку «Установки» и в диалоговом окне «Текущие установки - Устройства» устанавливаем такие же текущие установки, как и при установке титра тиосульфата натрия. Активируем кнопку «Старт» и титруем стандартным раствором тиосульфата натрия с шагом 0,5 мл, регистрируя величины силы тока после добавления каждой порции титранта. Титрование продолжаем до достижения тока нулевых значений тока. Результаты записываем в «Архив», а численные значения величины силы тока и объема титранта заносим в таблицу.
Строим кривую титрования в координатах I от V(Na2S2O3). Рассчитываем концентрацию иода в спиртовом растворе по формуле:
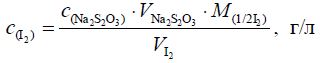
Рассчитывают стандартное отклонение среднего и доверительный интервал.
Вывод:
Приложение 1.
