
- •Будова атома і періодична система елементів
- •Ядерна модель будови атома.
- •Квантовані стани атома
- •Воднеподібні системи
- •Багатоелектронні атоми
- •Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах
- •Електронні структури ( конфігурації ) атомів
- •Електронна структура атомів і періодична система елементів
- •Періодичність властивостей хімічних елементів.
- •Залежність властивостей елементів від будови його атома та положення в періодичній системі.
Електронні структури ( конфігурації ) атомів
Умовний розподіл електронів по орбіталям на енергетичних рівнях і підрівнях називають електронною конфігурацією атома. Використовують 2 форми представлення. Розглянемо на прикладі атома сірки Z=16
а)1S²2S²2p⁶3S²3p⁴

[Ne]3S²3p⁴
б)
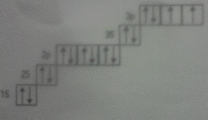
сумарний спін 0.5 + 0.5=1
У відповідності з правилом Хунда варіант б) дає інформацію про значення m1 електронів для окремих АО, число спарених і неспарених електронів.
[ ] - внутрішні або основні електрони - всі електрони, що містяться в атомі
інертного газу, який в пер. таблиці хімічних елементів стоїть перед даним елементом.
Якщо підрівні р-, d-, f- не повністю зайняті еквівалентними електронами, одній конфігурації відповідає декілька енергетичних стани, які називають атомними термами. Це результат взаємодії електронів. У відповідності з правилом Хунда для даної конфігурації з еквівалентними електронами основним станом буде стан з максимальним числом неспарених електронів на вироджених орбіталях (стан з максимальним сумарним спіном).
Нижчу енергію має терм з вищим значенням спіна. Мінімальній енергії атома відповідає максимальний сумарний спін (в одиницях h ).
В утворенні хімічних зв’язків найбільш активну участь приймають зовнішні (або валентні) електрони (підкреслені). Це ns-,np,(n-1) — електрони;
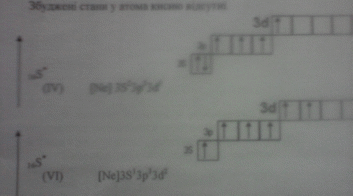
Атоми, знаходячись в основному стані, можуть поглинути квант енергії і перейти у збуджений стан з певною дискретною енергією, яка перевищує енергію основного стану на величину енергії поглинутого кванта.
Число неспарених електронів пояснює властивість насичення ковалентного зв’язку і визначає валентність атомів s-, р- елементів. Число неспарених електронів в такому атомі визначається правилом Хунда і наявністю вільних АО в тому ж квантовому шарі (рівні).
При збудженні атома електрони можуть переходити в ці вільні квантові енергетичні стани (квантові комірки), а атоми проявляти вищу валентність. Це можливо лише тоді, коли затрата енергії, необхідна для збудження атома і перехід електрона з однієї орбіталі на другу, невелика і компенсується енергією, що виділяється, при утворенні відповідної сполуки, в якій елемент проявляє вищу валентність.
Основний стан атомів:

Збуджений стан атомів

Електронна структура атомів і періодична система елементів
Електронна теорія будови атомів пояснює періодичну зміну властивостей елементів. Збільшення позитивних зарядів атомних ядер від 1 до 110 спричинює періодичне повторення будови зовнішнього енергетичного рівня. А оскільки властивості елементів залежать в основному від числа Д. І. Менделєєва властивості хімічних елементів, а також форми і властивості їх сполук знаходяться в періодичній залежності від заряду ядер їх атомів.
Будова періодичної системи пояснюється електронною теорією будови атомів:
В одному періоді знаходяться елементи, атоми яких у незбудженому стані мають однакове число енергетичних рівнів.
Число елементів у кожному періоді визначається шах можливим сумарним числом електронів на енергетичних підрівнях даного періода.
В одній підгрупі містяться елементи, які мають подібну будову зовнішніх енергетичних рівнів і як наслідок аналогічні хімічні властивості.
Залежно від того, який рівень останнім заповнюється електронами, всі елементи поділяють на чотири типи s-, р-, d-, f- елементи.
s — елементи мають електронну конфігурацію [ ] ns1 або ns² [ ] (де [ ] - електронна конфігурація попереднього інертного елемента). Це елементи головних підгруп 1-ї та 2-ї груп періодичної системи елементів. У вільному стані вони є металами (виняток водень).
р - елементи мають електронні конфігурації зовнішнього енергетичного рівня ns2nрх, де 1≤ х ≤6. В них електронами заповняються р - орбіталі зовнішнього рівня. Це елементи головних підгруп третьої - восьмої груп. Виявляють проміжні властивості між металічними та не металічними або неметалічні властивості.
d-елементи мають електронну конфігурацію [ ] nS²(n-1)d˟,де 1 ≤x ≤10.В них електронами заповнюються d-орбіталі передостаннього енергетичного рівня.Максимальне число 5-ти d-орбіталей 10.Це перехідні елементи побічних підгруп IV- VI періодів (z=21 - 30; г = 39- 48; z = 57; 72 - 80) у VII періоді z = 89, 104 - 110). У вільному стані метали.
f -елементи - в атомах, яких заповнюються 4f-, або 5f - орбіталі. Максимальне число електронів на 7 f-орбіталях 14. У VI періоді - лантаноїди z = 58-71, у VII періоді - актиноїди z = 90 - 103). Перехідні f - елементи знаходяться у побічній підгрупі 3-ї групи, у вільному стані - метали.
Число електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп (крім Не) = номеру групи періодичної системи.
Електронна теорія будови атомів пояснює також структуру періодичної системи - число груп, підгруп, періодів, положення елементів у групах і періодах.
У побічні підгрупи входять елементи , атоми яких мають на зовнішньому рівні по два або по одному електрону.
У елементів побічних підгруп валентними є електрони не тільки зовнішніх, а й передостанніх рівней.
Номер групи, як правило, вказує число електронів, які можуть брати участь в утворенні хімічного хв’язку.
