
- •Будова атома і періодична система елементів
- •Ядерна модель будови атома.
- •Квантовані стани атома
- •Воднеподібні системи
- •Багатоелектронні атоми
- •Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах
- •Електронні структури ( конфігурації ) атомів
- •Електронна структура атомів і періодична система елементів
- •Періодичність властивостей хімічних елементів.
- •Залежність властивостей елементів від будови його атома та положення в періодичній системі.
Багатоелектронні атоми
Одержати точний розв’язок рівняння Шредінгера для багатоелектронної системи неможливо бо електрон рухається не в центральному полі одного ядра, а в полі ядра та останніх електронів (остова атома). Як раз міжелектронне відштовхування не дозволяє точно розв’язати рівняння.
Нині найбільш широко з усіх наближених методів такого врахування застосовується одноелектронне наближення руху електрона, метод самоузгодженого поля, метод Хартрі - Фока. За цим методом хвильова функція атома представляє собою добуток самоузгоджених одноелектронних хвильових функцій, що описують кожний із електронів в полі ядра і усіх останніх електронів (АО Хартрі).
Реальний
потенціал, діючий на даний електрон,
можна замінити сумою потенціала ядра
і усерекдненого потенціала останніх
n-1 електронів. Ефективний
заряд остова 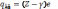 (
де Z-пopядкoвий номер елемента в періодичній
системі,
(
де Z-пopядкoвий номер елемента в періодичній
системі, 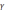 – коефіцієнт екранування, показує
наскільки заряд ядра, діючий на даний
електрон, нейтралізується останніми
електронами ). Поле, створене атомним
остовом, хоча і не кулонівське,
має центральну симетрію, як і поле
ядра у воднеподімному атомі. Тому і в
розглядаємому випадку квантові числа
n і I
зберігають своє значення. Але на відміну
від воднеподібного атома енергія
електрона залежить не тільки від n,
а і від I, бо енергія
електрона залежить від того, як він
поляризує остов
атома (порушує його центральну симетрію)
і як він проникає в середину остова.
Поляризація ж і проникнення
залежать від типу орбіталі АО, т.б.
від орбітального квантового числа I.
– коефіцієнт екранування, показує
наскільки заряд ядра, діючий на даний
електрон, нейтралізується останніми
електронами ). Поле, створене атомним
остовом, хоча і не кулонівське,
має центральну симетрію, як і поле
ядра у воднеподімному атомі. Тому і в
розглядаємому випадку квантові числа
n і I
зберігають своє значення. Але на відміну
від воднеподібного атома енергія
електрона залежить не тільки від n,
а і від I, бо енергія
електрона залежить від того, як він
поляризує остов
атома (порушує його центральну симетрію)
і як він проникає в середину остова.
Поляризація ж і проникнення
залежать від типу орбіталі АО, т.б.
від орбітального квантового числа I.
Найбільш „проникаючими” у даному квантовому шарі є s - орбіталі, так як їх максимуми лежать ближче всього до ядра; в ряду s-, р-, d-, f-підрівней „проникнення” зменшується. Тому в даному шарі більш зв’язані з ядром є s-, потім р-електрони і т. д. У електронному шарі з даним головним квантовим числом n електрони розрізняються по енергії в залежності від того до якого із підрівней вони належать. Відмінності зростають із збільшенням заряду ядра. Т. чином, виродження відносно квантового числа I у багатоелектронному атомі знімається.
Взаємний вплив електронів один на одного в багатоелектронних атомах обумовлює зміну послідовності зростання енергії орбіталей в порівнянні з послідовністю у воднеподібних системах.
На основі вивчення спектрів атомів і квантово-механічних розрахунків встановлена така послідовність енергетичних підрівнів у багатоелектронних атомах
1s<2s<2р<Зs<Зр<4s<Зd<4р<5s<4d<5р<бs<4f<5d<6р<7s<5f 6d<7р .
Для запам’ятовування послідовності АО зручно користуватися емпіричним правилом Клечковського (Маделунга): АО слідують у послідовності зростання суми кв. чисел ( n+1); при чому, у групі рівней з однаковим значенням n+1 першими слідують рівні з меншим значенням n .
(Слід відмітити, правило є наближеним).
Квантово-механічні розрахунки показують, що кожний енергетичний рівень багатоелектронного атому розщеплюється на таке число енергетичних підрівнів, скільки видів орбіталей включає цей рівень.
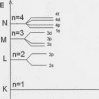
Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах
В основі лежать 2 фундаментальних принципи і одно правило:
1. Принцип заборони Паулі (швейцарський фізик Вольфганг Паулі (1900-1958 р.) ) - в атомі не може бути 2-х електронів , які характеризуються однаковим набором усіх 4-х квантових чисел.
( Принцип Паулі пов’язаний з фундаментальним принципом квантової механіки – про неможливість розпізнати тотожні частинки у мікросвіті. Електрони - ферміони).
2. Принцип мінімуму внутрішньої енергії ( довільна система намагається досягати стану з min - ним запасом внутрішньої енергії).
При виконанні цих принципів діє
правило Хунда (Гунда) (німецький фізик Ф. Хунд, 1927 р.) - заселення електронами орбіталей даного підрівня відбувається так, щоб їх сумарний спін був максимальним:
а) під час заповнення підрівня електрони посідають різні орбіталі доти, поки це можливо;
б) спіни поодиноких електронів на різних орбіталях паралельні.
