
- •Будова атома і періодична система елементів
- •Ядерна модель будови атома.
- •Квантовані стани атома
- •Воднеподібні системи
- •Багатоелектронні атоми
- •Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах
- •Електронні структури ( конфігурації ) атомів
- •Електронна структура атомів і періодична система елементів
- •Періодичність властивостей хімічних елементів.
- •Залежність властивостей елементів від будови його атома та положення в періодичній системі.
Квантовані стани атома
Завдяки малим розмірам і великій масі ядро атома можна наближено вважати точковим, що знаходиться в центрі мас атома і розглядати атом як систему електронів, які рухаються навколо нерухомого центра - ядра. Повна енергія такої системи Е = сумі кінетичної енергії всіх електронів і потенціальної енергії, яка складається із енергії притягання електронів ядром і енергії взаємного відштовхування електронів один від одного. Атом підпорядковується законам квантової механіки; його основна характеристика як квантової системи - повна енергія Е може приймати лише одне із значень дискретного ряду E1<E2<E3<... . Кожному із „дозволених” значень Еi відповідає один або декілька стаціонарних (незмінних з часом) станів атома. Енергія Е може змінюватися тільки стрибкоподібно - шляхом квантового переходу атома із одного стаціонарного стану в другий.
Методами квантової механіки можна точно розрахувати Е для одноелектронних атомів - воднеподібних систем.
Воднеподібні системи
H,He+,Li++
Стан електрона у воднеподібному атомі описується хвильовою функцією Ψ, яка є розв’язком стаціонарного рівняння Шредінгера :
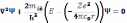
Не вдаючись до математичного розв’язання цієї задачі, обмежимось розглядом лише її важливих результатів.
Енергія
Рівняння Шредінгера має розв’язки , що зодовольняють вимогам однозначності, скінченності і неперервності хвильової функції ϕ лише при дискретних (власних) значеннях енергії
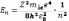 , (n=1,2,3,…)
, (n=1,2,3,…)
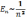 . (див. Рис.)
. (див. Рис.)
2. Квантові числа
Рівняння Шредінгера задовольняють власні хвильові функції Ψ=Ψn,I,mI , які
визначаються трьома квантовими числами:
головним n;орбітальним I ;магнітним орбітальним mI. ( вони зв’язані).
Головне квантове число, n
n -визначає середню відстань від ядра до ділянки підвищеної електронної густини, т.б. розміри електронної хмари та загальну енергію електрона на даному рівні; може набувати додатні цілочислові значення п = 1,2,3,4,...,∞.
Стан електрона , який характеризується певним n, називають енергетичним рівнем електрона в атомі. Для енергетичних рівнів електрона в атомі прийняті латинські позначення
Головне квантове число |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Енергетичні рівні |
К |
L |
M |
N |
O |
Р |
Q |
Max кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, в якому розміщений даний хім. елемент.
Орбітальне квантове число, І
Тонка структура лінійчастих спектрів (мультиплетність) (складаються з кількох близько розміщених ліній, які відповідають переходу електрона з одного енергетичного рівня на інший) вказує на різні квантовані стани електрона на певному енергетичному рівні, що зумовлено різною формою електронних орбіталей. От же, основні енергетичні рівні складаються з певного числа енергетичних підрівнів.
Для характеристики енергії електрона на підрівні та форми електронних орбіталей, введено орбітальне квантове число I.
З розв’язків рівняння Шредінгера випливає, що орбітальний момент імпульсу електрона LI квантується. Його модуль не може бути довільним, а набуває дискретних значень
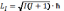 ,
,
при заданому n I набуває стільки ж значень I = 0, 1, 2,..., (n-1).
Кожному I відповідає певний енергетичний підрівень
Орбітальне квантове число, I |
0 |
1 |
2 |
3 |
Енергетичний підрівень |
s |
р |
d |
f |
( Буквені позначення підрівнів відповідають першим буквам англійських назв відповідних спектральних ліній, що виникають внаслідок електронних переходів , відповідно до значень I
sharp -різка; principal -ocновнa;diffus -дифузна; fundamental -фундаментальна ).
Можлива кількість підрівнів для даного енергетичного рівня п рівна номеру цього
рівня.
Магнітне орбітальне квантове число, mI,
У магнітному полі спектральні лінії атомів стають ширшими або розщепляються (з’являються нові близько розташовані лінії), збільшується мультиплетність. Це пояснюється тим, що електрон в атомі на всіх підрівнях(крім s -підрівня) характеризується крім орбітальним ще й магнітним орбітальним моментом. ( див. Рис.) Енергетичні зміни, які при цьому відбуваються , можна пояснити різним розміщенням електронних орбіталей у просторі, яке характеризується mI.
Магнітне поле орієнтує площину електронної орбіталі у просторі під певними кутами ( відбувається просторове квантування), при яких проекція орбітального моменту імпульсу LIz на напрямок зовнішнього поля набуває квантованих значень кратних ħ
LIZ=mI·ħ
де mI = 0, ±1,±2, … ,±I.
Т.б.
всього  може прийняти (2I+1) можливих
орієнтації
може прийняти (2I+1) можливих
орієнтації
При даних n і I може бути декілька станів електрона з однаковою енергією. Такі стани називають виродженими.
Тому:
s - стан вироджено 1 раз, бо I= 0 mI має 1 значення
р - стан вироджено 3 рази, бо I=1 mI має 3 значення
d - стан вироджено 5 разів, бо I=2 mI має 5 значень
f - стан вироджено 7 разів, бо I=3 mI має 7 значень
За характером орієнтації у просторі
р- орбіталі позначають Px, Py, Pz;
d-орбіталі

f - орбіталі мають ще складнішу форму. (див. Рис.)
Число
різних станів, що відповідає даному
n
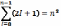
Квантові стани електронів; ємність рівнів, підрівнів електронних оболонок
Досліди Штерна і Герлаха. Спін електрона. Спінове квантове число.
У
дослідах по вимірюванню магнітних
моментів атомів елементів ІА гр., у яких
валентний електрон не має орбітального
моменту імпульсу ( I
= 0 ), а отже відсутній і орбітальний
магнітний момент ( mI=0
) німецькими фізиками О. Штерном і В.
Герлахом у 1921 в неоднорідному магнітному
полі було встановлене просторове
квантування. Цей експериментальний
факт у 1925 р. пояснили американськи вчені
Гаудсміт і Уленбек наявністю у електрона
власного моменту імпульсу ( спіну,
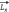 ) та зв’язаному з ним власного
магнітного моменту
) та зв’язаному з ним власного
магнітного моменту 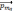 .
.
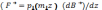 ;
- неможна дати наочної класичної
інтерпретації, це чисто квантова
характеристика частинки. Разом з масою
й зарядом спін є важливішою постійною
частинки. Він характеризує не тільки
електрон, але й протон, нейтрон, фотон
та інші частинки).
;
- неможна дати наочної класичної
інтерпретації, це чисто квантова
характеристика частинки. Разом з масою
й зарядом спін є важливішою постійною
частинки. Він характеризує не тільки
електрон, але й протон, нейтрон, фотон
та інші частинки).
Модуль власного моменту імпульсу квантується по закону
 s - спінове квантове
число,
s - спінове квантове
число, 
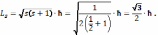
Проекція спіна на напрямок зовнішнього магнітного поля є квантованою величиною та визначається
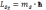 , ms
- магнітне спінове квантове число,
, ms
- магнітне спінове квантове число,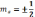 .
.
