
- •Будова атома і періодична система елементів
- •Ядерна модель будови атома.
- •Квантовані стани атома
- •Воднеподібні системи
- •Багатоелектронні атоми
- •Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах
- •Електронні структури ( конфігурації ) атомів
- •Електронна структура атомів і періодична система елементів
- •Періодичність властивостей хімічних елементів.
- •Залежність властивостей елементів від будови його атома та положення в періодичній системі.
Будова атома і періодична система елементів
Будова атома
1.Ядерна модель будови атома.
Розвиток теорії будови атома (самостійно).
2. Основні властивості і будова ядер.
3.Будова електронних оболонок атома.
4. Квантові стани атомів.
5. Послідовність заповнення електронами енергетичних рівнів в багато електронних атомах. Електронні структури (формули) атомів і періодична система елементів.
Відкриття зроблені у другій половині XIX столітті змусили змінити уявлення про атом як неділиму частинку (явища електролізу; іонізація газів; катодні промені; фотоефект; радіоактивність; індивідуальність спектрів випромінювання; поглинання кожним хімічним елементом; визначення числа NA Авогадро; рентгенівські промені; існування ізотопів хімічних елементів; додатніх іонів при електричних розрядах в газах, відкриття періодичного закону та створення періодичної системи елементів Д. І. Менделєєвим, ін.
Тому на початку XX століття серйозно стало питання про будову атома.
Ядерна модель будови атома.
Безпосередньо із дослідів Резерфорда (1911р.) по розсіюванню α -частинок на тонких шарах золота витікають наступні висновки:
1) атоми мають ядра, в яких зосереджена майже вся маса атома і весь позитивний заряд;
2) ядро має розміри ≈10-15 ÷10-14м;
3) електрони рухаються навколо ядра, утворюючи електронну оболонку атому;
4) (в силу електронейтральності атома) число електронів в атомі дорівнює порядковому номеру елемента в періодичній системі.
Носіями властивостей хімічних елементів є атоми. Взаємодіючи один з одним, атоми утворюють усю різноманітність оточуючих нас речовин. Для розуміння того, як відбувається взаємодія атомів, необхідно мати уявлення про їх внутрішню будову.
Сучасна теорія будови атома базується на законах, що описують рух мікрочастинок. Оскільки їх маса і розміри надзвичайно малі, то властивості і закономірності руху окремої мікрочастинки якісно відрізняються від властивостей і закономірностей руху макроскопічних тіл. їх вивчає квантова механіка. Вона базується на уявленнях про квантування енергії, хвильовому характері руху мікрочастинок та імовірному (статистичному ) методі опису мікрооб’єктів.
Електронна структура атомів
Як зазначалось, під час хімічної реакції ядра атомів не змінюються. Змін зазнають електронні оболонки атомів. їх будовою і енергією зв’язку електронів з ядром пояснюються багато властивостей хімічних елементів.
Розглянемо стан електронів в атомі і структуру їх електронних оболонок.
(Сучасна модель стану електрона в атомі).
Електронна хмара. Хвильова функція
Точне положення електрона в атомі в певний момент часу встановити неможливо внаслідок існування співвідношення невизначеностей Гейзенберга (для координати і імпульсу, енергії і часу) в силу його хвильових властивостей
Електрон у атомі можна уявити як хмару з певною густиною від’ємного електричного заряду в певному об’ємі простору навколо ядра. Оскільки рух електрона має хвильовий характер, то він описується за допомогою хвильового рівняння подібно тому як описуються акустичні, світлові хвилі. Таке рівняння було запропоноване у 1926р. австрійским вченим Ервіном Шредінгером. Це диферненціальне рівняння II порядку в частинних похідних для 1-го електрона у трьохмірному просторі. Стаціонарне хвильове рівняння (коли ϕ не залежить від часу)

Величину Ψ, що кількісно характеризує амплітуду трьохмірної хвилі, зв’язаної з рухом електрона, називають хвильовою функцією або „псі”-функцією.
Е - повна енергія електрона (частинки);
U - потенціальна енергія електрона в полі потенціальних сил ядра;
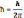 ,
h =6,63*10-34 Дж с; måë
- маса електрона.
,
h =6,63*10-34 Дж с; måë
- маса електрона.
Ψ - приймає комплексні значення. Фізичний зміст має не сама ϕ-функція, а квадрат її модуля
 -
характеризує густину ймовірності
знаходження електрона
-
характеризує густину ймовірності
знаходження електрона
і 12
у
деякій точці простору. Величина  - є ймовірністю знаходження
електрона в
- є ймовірністю знаходження
електрона в
елементі об’єму dV в „окрестности” певної точки атомного простору. Визначаючи значення хвильової функції, що задовольняють рівняння Шредінгера, ми знаходимо той простір біля ядра, в якому з найбільшою ймовірністю перебуває електрон (його називають атомною орбіталлю, АО).
Слід вказати, що розв’язки хвильового ріняння (просторові хвильові функції електрона) можливі тільки при певних дискретних значеннях енергії Е1, Е2, ... , Еn. Таким чином, на відміну постулатам Бора існування квантованих станів, які характеризуються квантованими значеннями енергії мікросистеми строго безпосередньо витікає із розв’язку хвильового рівняння.
