
- •Техніка безпеки при роботі в лабораторії.
- •Перша допомога.
- •Розділ і Біогенні s- та р-елементи, біологічна роль, застосування в медицині
- •Вміст у організміта значення для організму макроелементів
- •Якісна реакція на катіони лужних металів - фарбування полум'я в наступні кольори:
- •Загальні хімічні властивості
- •Біологічна роль та застосування в медициніs та р – елементів
- •Заняття №1 Тема:Біогенні s-елементи; біологічна роль, застосування в медицині.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Заняття №2
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •3.Фізичні властивості :
- •4. Хімічні властивостіd-елементів і їх сполук виходячи з будови атомів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання:
- •Приклад завдань для тестового контролю:
- •Методика виконання лабораторної роботи
- •Розділ 3 Комплексні сполуки
- •Класифікація та номенклатура комплексних сполук
- •Хімічний зв’язок у комплексних сполуках
- •Заняття №4
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Розділ 4 Вчення про розчини. Кислотно-основна рівновага біологічних рідин в організмі
- •Приклади розв’язування задач за темою «Розчини»
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 5. Розчини електролітів
- •Слабкі електроліти.
- •Сильні електроліти.
- •Теорія кислот і основ.
- •Дисоціація води.
- •Гідроліз солей. Ступінь та константа гідролізу
- •Буферні розчини.
- •Біохімічні буферні системи.
- •Самостійна позааудиторна робота студентів.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 7
- •Основні поняття:
- •1Г вуглеводів 19,6кДж
- •Хімічний склад і калорійність харчових продуктів
- •Задача 3
- •Задача 4
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
- •Розділ 8. Хімічна кінетика
- •Залежність швидкості реакції від різних факторів.
- •Теорія активних комплексів.
- •Теорії каталізу
- •Ферментативний каталіз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9
- •Гальваноз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Йонообмінна хроматографія. В основі лежить процес йонного обміну
- •Тонкошарова хроматографія
- •Хроматографія на папері.
- •Заняття№15
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Заняття 16
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9 Дисперсні системи
- •Класифікація за ступенем дисперсності подідяють:
- •Класифікація дисперсних систем за агрегатним станом
- •Молекулярно-кінетичні властивості колоїдних систем
- •Оптичні властивості колоїдних систем.
- •Явища, що супроводжують коагуляцію.
- •Коагуляція в біологічних системах.
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 10 Розділ 9. Високомолекулярні сполуки
- •Контрольні питання.
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Розділ 11 класифікація і номенклатура органічних сполук. Реакційна здатність алканів, алкенів, аренів.
- •Теорія будови органічних сполук а.М. Бутлерова:
- •Класифікація органічних сполук
- •Основні класи органічних сполук
- •Номенклатура органічних сполук
- •Класифікація реакцій в органічній хімії
- •Насичені вуглеводні (алкани)
- •Гомологічний ряд алканів
- •Будова молекули Метану
- •Ізомерія
- •Фізичні властивості
- •Хімічні властивості
- •Ненасичені вуглеводні (Алкени, алкадієни, алкіни)
- •Алкени. Гомологічний ряд алкенів.
- •Електронна будова подвійного зв’язку
- • Подвійний зв’язок – це ковалентний зв’язок, який складається з одного - і одного π-зв’язку. Подвійному зв’язку відповідає sp2- гібридизація. Ізомерія
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Алкадієни.
- •Хімічні властивості алкадієнів
- •Електронна будова потрійного зв’язку
- •Потрійний зв’язок – це ковалентний зв’язок, який складається з одного - і двох π- звязків. Потрійному зв’язку відповідає sp гібридизація. Фізичні властивості алкінів
- •Хімічні властивості
- •I. Реакції приєднання:
- •Ароматичні вуглеводні (арени)
- •Будова молекули бензолу (бензену)
- •Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1)Гідрування:
- •2)Галогенування
- •Правила орієнтації в бензольному ядрі
- •Заняття 21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Заняття №22.
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Розділ 12 оксигенвмісні органічні сполуки
- •Спирти.
- •Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Заняття 23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті.
- •Одержання
- •Гідратація алкінів: Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •4) Реакції полімеризації:
- •Реакції поліконденсації
- •Застосування
- •Заняття 24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •Дикарбоновимі кислотами називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи.
- •Естери (складні ефіри) – це сполуки, що складаються із залишку карбонової кислоти і спирту.
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Заняття 25.
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Методика виконання роботи
- •Розділ 15 дослідження хімічних властивостей моно- і полісахаридів.
- •Значення
- •Моносахариди. Будова. Ізомерія
- •Класифікація
- •Генетичний d- ряд сахаридів
- •Формули хеуорса
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •I. Реакції по карбонільній групі
- •1. Окиснення (для альдегідів)– призводить до утворення відповідних кислот.
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Класифікація і номенклатура
- •Застосування
- •Полісахариди
- •Крохмаль Будова молекули(розгалужений ланцюг)
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •Целюлоза (клітковина) Будова молекули(лінійний ланцюг)
- •Знаходження в природі
- •Застосування
- •Заняття № 26
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Розділ 16 дослідження реакційної здатності гетерофункціональних сполук. Амінокислоти
- •Найважливіші представники гідроксикислот.
- •Амінокислоти
- •Класифікація амінокислот.
- •Класифікація α-амінокислот
- •Ізомерія
- •Фізичні властивості
- •Одержання амінокислот
- •Хімічні властивості
- •Біполярний йон
- •Пептиди. Білки
- •Склад і будова молекули
- •Поширення в природі
- •Хімічні властивості
- •Заняття 28
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Заняття 29 Тема: α-Амінокислоти, пептиди, білки.
- •3. Конкретні цілі,вміти:
- •Самостійна робота на занятті..
- •Гетероциклічні сполуки Класифікація гетероциклів
- •Номенклатура гетероциклічних сполук
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли Властивості і реакції шестичленних гетероциклічних сполук
- •2Окиснення піридину і алкілпіридинів
- •Шестичленні гетероциклічні сполуки з двома гетероатомами
- •Біциклічні гетероцикли
- •Розділ 18 нуклеїнові кислоти
- •Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти.
Контрольні питання.
Електропровідність сильних і слабких електролітів.
Від яких факторів залежить електропровідність розчину?
Провідники 1-го і 2-го роду.
Постійна електродної посудини.
Що таке питома електропровідність?
Як змінюється питома електропровідність зі зміною концентрації розчинів сильних і слабких електролітів?
Що таке молярна електропровідність? Як зв’язані між собою питома і молярна електропровідність?
Як гранична еквівалентна електропровідність зв’язана з електричною рухливістю йонів?
Що таке гранична електропровідність? Закон Кольрауша.
Опір розчину AgNO3з молярною концентрацією еквівалентів 0,1 моль/л при 298К рівний 1090 Ом, а опір КСl з молярною концентрацією еквівалентів 0,02 моль/л в тій же електродній посудині при тих же умовах 4318 Ом, питома електропровідність його рівна 2,77.10-3Ом-1.см-1. Розрахувати постійну електродної посудини, питому та еквівалентну електропровідність розчину AgNO3.
Питома електропровідність розчину пропіонової кислоти з концентрацією
С(1/1С2Н5СООН) = 7,8.10-3 моль/л дорівнює 1,21.10-4 Ом-1.см-1. Обчислити ступінь і константу дисоціації пропіонової кислоти.
Самостійна робота на занятті.
Виконати лабораторні роботи:
Визначити константу електродної посудини.
Визначити електропровідність розчинів слабих електролітів.
Визначити ступінь і константу дисоціації досліджуваних електролітів
Методика виконання роботи
Робота 1. Визначення константи електродної посудини.
Визначення
константи електродної посудини проводять
за допомогою розчину електроліту, для
якого відоме значення питомої
електропровідності. З цією метою
використовують, як правило, 0,01 М
розчин Ксl,
для якого при 20 0С = 1,25
10-3См/м.
= 1,25
10-3См/м.
В посудину для визначення електропровідності наливають такий об’єм 0,01 М розчину Ксl , щоб електроди були повністю занурені в розчин. За допомогою омметра замірюють опір розчину в посудині і за формулою К = R вираховують її константу.
Робота 2.Визначення електропровідності розчинів слабих електролітів та біологічних рідин.
Визначивши постійну (константу) електродної посудини, останню старанно промивають дистильованою водою, наливають в неї відповідний досліджуваний розчин слабкого електроліту і вимірюють опір. Одержані дані заносять у таблицю:
№ п/п |
Досліджуваний розчин |
R |
|
|
|
1 |
0,1 М НСООН |
|
|
|
|
2. |
0,1 М СН3 СООН |
|
|
|
|
3. |
0,1 М ССl3 COOH |
|
|
|
|
4. |
0,1 М NH4 OH |
|
|
|
|
5. |
Шлунковий сік (1:10) |
|
|
|
- |
6. |
Сироватка крові (1:5) |
|
|
|
- |
Використовуючи знайдені величини опору досліджуваних розчинів і постійну електродної посудини (K) розраховують питому електропровідність :

і молярну електропровідність :
 де:
де:
 - питома електропровідність
- питома електропровідність
С - молярна концентрація
V
– розведення,
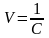
Для розчинів слабких електролітів розрахувати також граничну молярну електричну провідність, використовуючи дані довідника про електролітичну рухливість відповідних іонів :

Результати занести в таблицю і зробити висновок.
Робота 3.Порівняння сили електролітів на основі електропровідності їх розчинів.
Використовуючи дані із роботи № 2 про молярну електропровідність і граничну електропровідність відповідних розчинів електролітів, розраховують ступінь і константу дисоціації.
 ;
К=
;
К=
Дані занести у таблицю і зробити висновок про силу різних електролітів і як впливає введення хлору в радикал кислоти на її силу.
№ п/п |
Досліджуваний розчин |
|
К |
1 |
0,1 М НСНОН |
|
|
2. |
0,1 М СН3 СООН |
|
|
3. |
0,1 М ССl3 COOH |
|
|
4. |
0,1 МNH4 OH |
|
|
ЗАНЯТТЯ №14
Тема:Електродні потенціали та механізм їх виникнення. Потенціометрія
Актуальність теми:Потенціометричний метод дозволяє визначити концентрацію йонів водню в розчинах і різних біологічних рідинах. Наявність доступних вимірювальних приладів робить цей метод широко використовуваним на практиці. Знання закономірностей виникнення електродних потенціалів, будови електродів, вимірювання рН середовища дає в руки медиків інструмент для діагностики і коректування важливого показника різних рідин внутрішнього середовища організму.
Навчальні цілі:
Знати: суть методу потенціометрії, який дозволяє визначити концентрацію йонів в різних середовищах, будову електродів, принцип вимірювання за допомогою потенціометра.
Вміти: підготувати прилад до роботи, вимірювати рН різних розчинів і біологічних рідин, провести потенціометричне титрування і визначити концентрацію досліджуваного розчину.
Самостійна позааудиторна робота студентів.
Механізм виникнення подвійного електричного шару.
Електродний потенціал, фактори від яких залежить його значення.
Рівняння Нернста для окисно-відновних систем.
Стандартні електродні потенціали.
Класифікація електродів.
Електроди визначення. Скляний електрод, йонселективні електроди.
Електроди порівняння. Водневий електрод. Хлорсрібний електрод.
Суть потенціометричного методу визначення рН розчинів і біологічних рідин.
Потенціометричне титрування. Які електроди при цьому застосовуються?
Криві потенціометричного титрування. Визначення точки еквівалентності графічним методом.
Застосування методу потенціометрії в медицині.
Зубні протези в стоматології. Проблеми гальванозу.
При потенціометричному титруванні до 20 мл розчину NaOH додавали по 1 мл розчину HClC(HCl) = 0,15 моль /л. При цьому рН розчину змінювалось дуже повільно і до досягнення рН 9,7 було витрачено 14 мл розчину HCl. Після цього розчин HCl стали додавати порціями по 0,1 мл і при додаванні 0,4 розчину HCl рН різко змінився до 4,3. Розрахувати молярну концентрацію еквівалентів NaOH .





