
- •Техніка безпеки при роботі в лабораторії.
- •Перша допомога.
- •Розділ і Біогенні s- та р-елементи, біологічна роль, застосування в медицині
- •Вміст у організміта значення для організму макроелементів
- •Якісна реакція на катіони лужних металів - фарбування полум'я в наступні кольори:
- •Загальні хімічні властивості
- •Біологічна роль та застосування в медициніs та р – елементів
- •Заняття №1 Тема:Біогенні s-елементи; біологічна роль, застосування в медицині.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Заняття №2
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •3.Фізичні властивості :
- •4. Хімічні властивостіd-елементів і їх сполук виходячи з будови атомів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання:
- •Приклад завдань для тестового контролю:
- •Методика виконання лабораторної роботи
- •Розділ 3 Комплексні сполуки
- •Класифікація та номенклатура комплексних сполук
- •Хімічний зв’язок у комплексних сполуках
- •Заняття №4
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Розділ 4 Вчення про розчини. Кислотно-основна рівновага біологічних рідин в організмі
- •Приклади розв’язування задач за темою «Розчини»
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 5. Розчини електролітів
- •Слабкі електроліти.
- •Сильні електроліти.
- •Теорія кислот і основ.
- •Дисоціація води.
- •Гідроліз солей. Ступінь та константа гідролізу
- •Буферні розчини.
- •Біохімічні буферні системи.
- •Самостійна позааудиторна робота студентів.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 7
- •Основні поняття:
- •1Г вуглеводів 19,6кДж
- •Хімічний склад і калорійність харчових продуктів
- •Задача 3
- •Задача 4
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
- •Розділ 8. Хімічна кінетика
- •Залежність швидкості реакції від різних факторів.
- •Теорія активних комплексів.
- •Теорії каталізу
- •Ферментативний каталіз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9
- •Гальваноз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Йонообмінна хроматографія. В основі лежить процес йонного обміну
- •Тонкошарова хроматографія
- •Хроматографія на папері.
- •Заняття№15
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Заняття 16
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9 Дисперсні системи
- •Класифікація за ступенем дисперсності подідяють:
- •Класифікація дисперсних систем за агрегатним станом
- •Молекулярно-кінетичні властивості колоїдних систем
- •Оптичні властивості колоїдних систем.
- •Явища, що супроводжують коагуляцію.
- •Коагуляція в біологічних системах.
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 10 Розділ 9. Високомолекулярні сполуки
- •Контрольні питання.
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Розділ 11 класифікація і номенклатура органічних сполук. Реакційна здатність алканів, алкенів, аренів.
- •Теорія будови органічних сполук а.М. Бутлерова:
- •Класифікація органічних сполук
- •Основні класи органічних сполук
- •Номенклатура органічних сполук
- •Класифікація реакцій в органічній хімії
- •Насичені вуглеводні (алкани)
- •Гомологічний ряд алканів
- •Будова молекули Метану
- •Ізомерія
- •Фізичні властивості
- •Хімічні властивості
- •Ненасичені вуглеводні (Алкени, алкадієни, алкіни)
- •Алкени. Гомологічний ряд алкенів.
- •Електронна будова подвійного зв’язку
- • Подвійний зв’язок – це ковалентний зв’язок, який складається з одного - і одного π-зв’язку. Подвійному зв’язку відповідає sp2- гібридизація. Ізомерія
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Алкадієни.
- •Хімічні властивості алкадієнів
- •Електронна будова потрійного зв’язку
- •Потрійний зв’язок – це ковалентний зв’язок, який складається з одного - і двох π- звязків. Потрійному зв’язку відповідає sp гібридизація. Фізичні властивості алкінів
- •Хімічні властивості
- •I. Реакції приєднання:
- •Ароматичні вуглеводні (арени)
- •Будова молекули бензолу (бензену)
- •Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1)Гідрування:
- •2)Галогенування
- •Правила орієнтації в бензольному ядрі
- •Заняття 21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Заняття №22.
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Розділ 12 оксигенвмісні органічні сполуки
- •Спирти.
- •Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Заняття 23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті.
- •Одержання
- •Гідратація алкінів: Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •4) Реакції полімеризації:
- •Реакції поліконденсації
- •Застосування
- •Заняття 24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •Дикарбоновимі кислотами називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи.
- •Естери (складні ефіри) – це сполуки, що складаються із залишку карбонової кислоти і спирту.
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Заняття 25.
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Методика виконання роботи
- •Розділ 15 дослідження хімічних властивостей моно- і полісахаридів.
- •Значення
- •Моносахариди. Будова. Ізомерія
- •Класифікація
- •Генетичний d- ряд сахаридів
- •Формули хеуорса
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •I. Реакції по карбонільній групі
- •1. Окиснення (для альдегідів)– призводить до утворення відповідних кислот.
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Класифікація і номенклатура
- •Застосування
- •Полісахариди
- •Крохмаль Будова молекули(розгалужений ланцюг)
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •Целюлоза (клітковина) Будова молекули(лінійний ланцюг)
- •Знаходження в природі
- •Застосування
- •Заняття № 26
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Розділ 16 дослідження реакційної здатності гетерофункціональних сполук. Амінокислоти
- •Найважливіші представники гідроксикислот.
- •Амінокислоти
- •Класифікація амінокислот.
- •Класифікація α-амінокислот
- •Ізомерія
- •Фізичні властивості
- •Одержання амінокислот
- •Хімічні властивості
- •Біполярний йон
- •Пептиди. Білки
- •Склад і будова молекули
- •Поширення в природі
- •Хімічні властивості
- •Заняття 28
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Заняття 29 Тема: α-Амінокислоти, пептиди, білки.
- •3. Конкретні цілі,вміти:
- •Самостійна робота на занятті..
- •Гетероциклічні сполуки Класифікація гетероциклів
- •Номенклатура гетероциклічних сполук
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли Властивості і реакції шестичленних гетероциклічних сполук
- •2Окиснення піридину і алкілпіридинів
- •Шестичленні гетероциклічні сполуки з двома гетероатомами
- •Біциклічні гетероцикли
- •Розділ 18 нуклеїнові кислоти
- •Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти.
Гальваноз.
В ортопедичній стоматології для виготовлення зубів використовують близько 20 металів. Якщо у ротовій порожнині знаходяться протези з різних металів, то при змочуванні їх слиною утворюється гальванічний елемент. Електричний струм, що виникає під час його роботи приводить до появи паталогічних процесів, що дістали назву гальваноз. При цьому спостерігається металевий присмак, відчуття кислоти, зіпсуття смаку та слиновиділення. Хімічні реакції, які відбуваються при цьому можуть привести до появи алергічних захворювань, захворювань печінки, шлунково-кишкового тракту і інших хвороб. Тому сумісне застосування різних металів і різних сплавів недопустимо.
Приклади розв’язування задач.
Задача 1.
Питома електропровідність оцтової кислоти з молярною концентрацією еквівалентів 0,01 моль/л при 298 К = 1,56*10-2 См/м. Розрахувати ступінь і константу дисоціації даної кислоти, а також рН цього розчину.
Розв’язок.
1. Розраховуєм молярну (еквівалентну) електропровідність (λс)
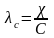 ,
де С
молярна концентрація в моль/м3.
,
де С
молярна концентрація в моль/м3.
Якщо С в моль/л, то враховуючи, що 1 м3 = 1000 л, то

2. Розраховуєм граничну електропровідність розчину використовуючи дані довідника враховуючи, що дисоціація:
СН3СООН=Н++СН3СОО-

3. Розраховуєм ступінь дисоціації:

4. Розраховуємо константу дисоціації:

Задача 2.
Визначити константу електродної посудини, питому і молярну електропровідності розчину AgNO3 з молярною концентрацією 0,1 моль/л, якщо його опір 1090 Ом, а в тих же умовах розчин КСІ з молярною концентрацією еквівалентів 0,02 моль/л має опір 431 Ом, а питома електропровідність його рівна
2,77*10-2См*м-1
Розв’язок.
Визначення питомої електропровідності розчину в електродній посудині можна провести за формулою:
,
де К
– стала посудини, R
– опір,
 - питома електропровідність.
- питома електропровідність.
Знаючи питому електропровідність стандартного розчину КСІ і його опір можна визначити сталу даної електродної посудини:

Знаючи К посудини можна визначити опір досліджуваного розчину АgNO3

Молярна електропровідність λ зв’язана з питомою:

ЗАНЯТТЯ №13
Тема:Розчини електролітів. Електроліти в організмі людини. Електропровідність розчинів:питома, молярна, гранична.
Актуальність теми:Здатність розчинів електролітів проводити електричний струм широко використовується в біології і медицині для діагностики і в лікувальній справі. Знання закономірностей електропровідності різних електролітів залежить від різних факторів, можливість вимірювати опір розчинів за допомогою доступних вимірювальних приладів робить даний метод необхідним для професійної підготовки лікарів.
Навчальні цілі:
Знати: залежність електропровідності розчинів від природи і різних факторів, взаємозв’язок між різними видами електропровідності, ступенем дисоціації і константою дисоціації.
Вміти: визначити опір розчину, питому і молярну електропровідність, ступінь дисоціації і константу дисоціації через вимірювання опору розчинів електролітів.
Самостійна позааудиторна робота студентів.
Електропровідність. Провідники 1-го і 2-го роду.
Електропровідність розчинів сильних і слабких електролітів. Фактори, що впливають на електропровідність.
Питома і молярна (еквівалентна) електропровідність розчинів.
Електропровідність при безмежному розведенні. Гранична електропровідність. Закон Кольрауша.
Вимірювання електропровідності за допомогою електродної посудини. Постійна електродної посудини.
Розмірність питомої і молярної електропровідності та рухливості йонів.
Розрахунок ступеня і константи електролітичної дисоціації через електропровідність.
Електропровідність клітин і тканин, їх біомедичне значення.
