
- •Глава 09. Патология крови
- •Дифференцировка клеток костного мозга
- •Патология эритроцитов
- •Эритроцитозы
- •Классификация анемий
- •Анемии при кровопотерях
- •Дисэритропоэтические анемии
- •Патология лейкоцитов
- •Лейкемоидные реакции
- •Гемобластозы
- •Новообразования миелоидной ткани
- •Острые миелоидные лейкозы
- •Миелодиспластические (миелопролиферативные) заболевания
- •Миелодиспластические синдромы
- •Новообразования лимфоидной ткани
- •Международная классификация новообразований лимфоидной ткани
- •III. Болезнь Ходжкина.
- •Острые лимфобластные лейкозы
- •Хронический лимфоцитарный лейкоз
- •Опухоли из плазматических клеток
- •Болезнь ходжкина
- •Лимфомы кожи
- •Опухоли из гистиоцитов
- •Опухоли из тучных клеток
- •Тромбоцитарные заболевания. Коагулопатии
- •Нарушения сосудистых факторов свёртывания
- •Нарушения плазменных факторов свёртывания
- •Гемофилия
- •Болезнь виллебранда
- •Нарушения тромбоцитарных факторов свёртывания
- •К началу статьи • дифференцировка клеток костного мозга • патология эритроцитов •
Классификация анемий
● Анемии после кровопотери или разрушения эритроцитов (постгеморрагические и гемолитические анемии).
● Анемии при недостаточном воспроизводстве эритроцитов (дизэритропоэтические, гипопластические, апластические анемии).
Основные проявления анемии связаны со снижением способности крови к переносу кислорода, что приводит к гипоксии тканей. Пациенты бледны, их беспокоят утомляемость, головокружение, парестезии (спонтанно возникающее чувство онемения, покалывания в конечностях), одышка при физическом напряжении. Возникают изменения ногтей (койлонихии — ложкообразные ногти, признак дефицита железа), жировая дистрофия и липофусциноз печени, миокарда. Жировая дистрофия миокарда способствует развитию сердечной недостаточности и может отягощать течение ИБС у пациентов, анемия усиливает гипоксию миокарда, вызванную атеросклеротическим стенозом коронарных артерий. Повышение сосудистой проницаемости, вызванное гипоксией, приводит к отёку, склерозу стромы, диапедезным кровоизлияниям и местному гемосидерозу. Одновременно развиваются компенсаторные процессы: повышение минутного объёма сердца, уменьшение времени циркуляции, соответственно, возрастает перфузия тканей. При прогрессировании болезни сердечная недостаточность с высоким минутным объёмом сердца опасна для жизни.
Анемии при кровопотерях
Постгеморрагическая анемия может быть острой и хронической.
● Острая постгеморрагическая анемия. Кровопотеря может быть смертельной при утрате 40–50% общего объёма крови (в среднем, 2–3 л). Потеря крови более 20–25% угрожает жизни. Причины смерти при острой кровопотере — острая гипоксия головного мозга и постгеморрагический шок с развитием шоковой почки и других изменений. В первые часы после кровотечения анемия нормохромная нормоцитарная. Восстановление объёма плазмы после острой кровопотери вызывает временное разжижение крови и снижение гематокрита. Первый признак регенерации эритроцитов — ретикулоцитоз. В течение нескольких часов после кровопотери мобилизация гранулоцитов и тромбоцитов из депо приводит к умеренной нейтрофилии и тромбоцитозу.
● Хроническая постгеморрагическая анемия возникает при хронической кровопотере, может быть симптомом гинекологических, онкологических заболеваний, болезней желудочно-кишечного тракта. Характерные признаки анемии: гипохромия, микроцитоз, (рис. 9-1) фокусы регенерации в костном мозге трубчатых костей, очаги внекостномозгового кроветворения, изменения, обусловленные хронической гипоксией.
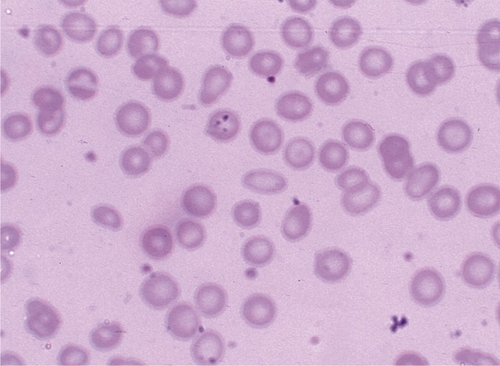
Рис. 9-1. Железодефицитная анемия. Гипохромия, микроцитоз. Окраска по Романовскому–Гимзе (x600).
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
Гемолитические анемии — многочисленная группа анемий, их диагностические признаки — повышенное разрушение и укорочение жизни эритроцитов.
Классификация гемолитических анемий.
● По причине гемолиза:
эндоэритроцитарные (связанные с аномалиями самого эритроцита);
экзоэритроцитарные.
● По локализации гемолиза:
внесосудистые;
внутрисосудистые.
● По времени возникновения:
врождённые;
приобретённые.
Классификация гемолитических анемий.
● Анемии, обусловленные эндоэритроцитарными факторами (внесосудистый гемолиз).
◊ Наследственные анемии.
Ä Анемии, связанные с нарушением структуры плазмолеммы эритроцитов, или мембранопатии (стоматоцитоз, микросфероцитоз, овалоцитоз, нарушение структуры липидов мембраны эритроцитов и т.д.).
Ä Анемии, обусловленные дефицитом ферментов эритроцитов (ферментопатии):
недостаточная активность ферментов гликолиза;
недостаточная активность ферментов пентозофосфатного шунта;
недостаточная активность ферментов глютатионовой системы.
Ä Анемии с нарушенным синтезом глобина (гемоглобинопатии):
носительство аномальных гемоглобинов (HbS, HbC, HbD и др.);
носительство аномальных нестабильных гемоглобинов (неустойчивость глобина к действию окислителей, нагреванию в результате замены аминокислот);
талассемии (дисбаланс и снижение синтеза полипептидных цепей).
◊ Приобретённые анемии.
Ä Пароксизмальная ночная гемоглобинурия (соматическая мутация клеток — предшественников миелопоэза).
● Анемии, обусловленные экзоэритроцитарными факторами (внутрисосудистый гемолиз).
◊ Приобретённые анемии.
Ä Аутоиммунные гемолитические анемии:
обусловленные неполными и полными холодовыми или тепловыми антителами;
анемии при аутоиммунных заболеваниях;
другие варианты (идиопатическая, лекарственная анемии).
Ä Изоиммунные гемолитические анемии:
гемолитическая болезнь новорождённых;
трансфузионная гемолитическая реакция.
Ä Механическое повреждение эритроцитов:
микроангиопатические анемии;
анемия при патологии или протезировании клапанов сердца;
маршевая гемоглобинурия.
Ä Лекарственный иммунный гемолиз.
Ä Анемии при инфекционных заболеваниях (малярия).
Ä Анемии, вызванные гемолитическими токсинами и веществами.
Ä Гиперспленизм.
● Смешанные виды анемий.
У большинства лиц с гемолитическими заболеваниями разрушение патологически изменённых эритроцитов происходит с помощью макрофагов в селезёнке, печени и костном мозге путём внесосудистого гемолиза. Внутрисосудистый гемолиз вызывает выделение гемоглобина в кровь. Это бывает при тяжёлом повреждении плазмолеммы нормальных эритроцитов под действием внешних причин, например, антител, комплемента, токсичных химикатов или механических факторов.
Вслед за фагоцитозом эритроцитов происходит распад молекулы гемоглобина на гем и глобин. Если конверсия гемоглобина в билирубин превышает способность печени конъюгировать билирубин и выделять его с жёлчью, развивается желтуха. Неконъюгированный билирубин не может проходить через гломерулярную мембрану и не попадает в мочу (ахолурическая желтуха). Секреция конъюгированного билирубина возможна в жёлчные канальцы. Увеличение концентрации билирубина в жёлчи предрасполагает к формированию пигментных жёлчных камней. Чаще это происходит при врождённых гемолитических анемиях. Высокий уровень билирубина плазмы крови при гемолитической болезни новорождённых может вызвать токсическое повреждение жёлчными пигментами и кислотами клеток базальных ядер головного мозга и билирубиновую энцефалопатию.
При гемолитических состояниях в костном мозге возможно значительное увеличение воспроизводства эритроцитов — компенсаторный эритропоэз. Количество ретикулоцитов всегда повышено. Анемия обычно нормоцитарная, при этом может быть небольшой макроцитоз. В костном мозге развивается эритробластическая гиперплазия, иногда с явлениями эритрофагоцитоза. Костномозговая ткань распространяется по каналам длинных трубчатых костей, постепенно происходят расширение каналов и полостей (в губчатых костях), атрофия и исчезновение костных трабекул, истончение кортикальной пластинки, возможна деформация кости. Из-за присоединения недостаточности фолиевой кислоты возможны мегалобластические (макроцитарные) изменения эритроцитов. При тяжёлом и хроническом вариантах анемии наблюдают экстрамедуллярный гемопоэз и общий гемосидероз с накоплением гемосидерина в звёздчатых эндотелиоцитах печени (клетках Купффера) и макрофагах селезёнки, а также спленомегалию. Изменённые эритроциты теряют пластичность — физиологическую способность к деформации, что может быть причиной тромбозов и, следовательно, инфарктов.
Наследственные гемолитические анемии
Наследственные гемолитические анемии вызваны эндоэритроцитарными факторами, для них характерен внесосудистый гемолиз. В зависимости от характера изменений эритроцитов выделяют следующие группы анемий.
● Анемии, связанные с нарушением структуры плазмолеммы эритроцитов — мембранопатии (стоматоцитоз, микросфероцитоз, овалоцитоз; анемии, обусловленные нарушением структуры липидов мембраны эритроцитов и т.д.).
● Анемии, обусловленные дефицитом ферментов эритроцитов-ферментопатии (недостаточная активность ферментов гликолиза, пентозофосфатного шунта, глютатионовой системы).
● Анемии, связанные с нарушенным синтезом глобина — гемоглобинопатии, вызванные носительством аномальных гемоглобинов (HbS, HbC, HbD и др.). Это приводит к неустойчивости глобина к действию окислителей или нагреванию в результате замены аминокислот, либо к талассемии — дисбалансу и снижению синтеза полипептидных цепей. Пример приобретённой анемии с внесосудистым гемолизом — пароксизмальная ночная гемоглобинурия, вызванная соматической мутацией клеток — предшественников миелопоэза.
Наследственные мембранные дефекты эритроцитов
◊ Наследственный сфероцитоз — хроническое гемолитическое заболевание с аутосомно-доминантным типом наследования, может быть следствием спонтанной мутации. Дефект в молекуле спектрина — одного из белков плазмолеммы эритроцитов вызывает неустойчивость плазмолеммы, поэтому эритроциты приобретают сферическую форму и теряют пластичность.
◊ Наследственный овалоцитоз (эллиптоцитоз) — появление в периферической крови эллипсовидных эритроцитов, по-видимому, также вследствие повреждения спектрина.
Наследственные ферментные повреждения эритроцитов
◊ Недостаточность глюкозо-6-фосфатдегидрогеназы — одно из наиболее частых наследственных заболеваний. Эта аномалия, сцепленная с Х-хромосомой, проявляется у мужчин и гомозиготных женщин.
◊ Недостаточность пируваткиназы имеет аутосомно-рецессивный тип наследования, гемолиз возможен лишь у гомозигот.
Жизнь нормальных эритроцитов зависит от главного источника энергии — глюкозы. После проникновения в клетку происходит её превращение в лактат путём анаэробного гликолиза (90%) или через гексозомонофосфатный шунт (10%). У пациентов с недостаточностью глюкозо-6-фосфатдегидрогеназы наблюдают свободное окисление гемоглобина до метгемоглобина, затем образующего преципитаты в виде телец Хайнца. Самое частое клиническое проявление — острый гемолитический приступ в ответ на «оксидантный стресс», например, острую инфекцию или приём лекарств. Ятрогенные факторы, действующие в качестве оксидантов, — противомалярийные препараты, сульфаниламиды, фурадонин, ацетилсалициловая кислота и витамин К.
Диагноз недостаточности глюкозо-6-фосфатдегидрогеназы ставят при наличии в мазке крови сморщенных и фрагментированных эритроцитов (часть из них содержит тельца Хайнца), и эритроцитов с небольшими краевыми дефектами, возможно, возникающими при разрушении телец Хайнца в селезёнке.
Гемоглобинопатии развиваются при нарушении синтеза глобиновых цепей, группы гема при этом нормальны. Существуют два основных варианта гемоглобинопатий.
● Гемоглобинопатии с продукцией аномальных глобиновых цепей в результате мутации генов. Группа включает носительство аномальных гемоглобинов (HbS, HbC, HbD и др.) и аномальных нестабильных гемоглобинов.
● Синдромы талассемии, когда сложные генетические дефекты приводят к нарушению количественного соотношения между глобиновыми цепями. Структура цепей гемоглобина не изменена.
Гемоглобинопатии вызывают снижение эритропоэза и продолжительности жизни эритроцитов. Таким образом, анемия имеет частично дизэритропоэтическую и частично гемолитическую природу. Гемоглобиновые варианты у 90% пациентов — следствие замены одного аминокислотного остатка в молекуле гемоглобина.
Серповидно-клеточная анемия — самый частый и важный вариант гемоглобинопатий (рис. 9-2). При серповидно-клеточной анемии возникает HbS. Его отличает от HbА замена остатка валина на остаток глутаминовой кислоты в 6-й позиции аминокислотной последовательности β-цепи.
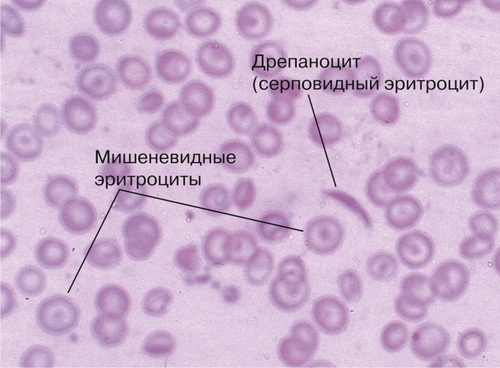
Рис. 9-2. Серповидноклеточная анемия. Окраска по Романовскому–Гимзе (x600).
● Гомозиготы (HbSS) всегда имеют признаки заболевания. У гетерозигот (HbAS) 40–50% HbS, как правило, у них заболевание протекает бессимптомно до наступления тяжёлого аноксического (гипоксического) состояния. Такую разновидность болезни называют серповидно-клеточной аномалией эритроцитов. Её географическое распределение связано с распространением малярии, вызываемой Plasmodium falciparum. Носители гена серповидно-клеточной аномалии от малярии защищены.
● Серповидная форма эритроцитов — результат полимеризации деоксигенированных молекул HbS, в таком состоянии они складываются особым линейным способом. Серповидную трансформацию красных кровяных телец выявляют in vitro при добавлении к крови восстанавливающего (отнимающего кислород) вещества.
● Симптоматика появляется у гомозигот уже в 6-месячном возрасте. Развиваются хроническая гемолитическая анемия и рецидивирующие болезненные кризы, связанные с окклюзией мелких сосудов серповидными эритроцитами, ишемией тканей и инфарктами. Чаще других бывают поражены печень, селезёнка, кости, лёгкие, головной мозг и сетчатка глаз. Развитие кризов может быть спровоцировано инфекциями, физической нагрузкой, обезвоживанием и беременностью. Спленомегалия возникает в раннем детском возрасте. Позднее повторные кризы с инфарктами селезёнки приводят к её атрофии с выключением функций. Такие лица подвержены тяжёлым бактериальным инфекциям, особенно респираторным, у них могут развиться септицемия, менингит и остеомиелит. Тяжёлая инфекция способна приводить к гипоплазии костного мозга (апластическому кризу).
● Замена внутренних аминокислот возможна при трёх группах заболеваний.
◊ Анемии с нестабильным гемоглобином — самая большая группа. При замене аминокислотных остатков происходит повреждение места прикрепления гема. Нестабильный гемоглобин подвержен денатурации, в эритроцитах видны тельца Хайнца.
◊ HbМ-варианты представлены врождённой метгемоглобинемией. Характерен цианоз тканей вследствие неспособности метгемоглобина связывать кислород.
◊ Гемоглобины с изменёнными свойствами в большинстве случаев слишком прочно связывают кислород, что приводит к последующей гипоксии тканей и эритроцитозу.
Талассемии — гетерогенная группа наследственных заболеваний, в их основе — нарушение синтеза одной из полипептидных цепей глобина, что приводит к увеличению синтеза других цепей и развитию дисбаланса между ними. Накопление и отложение избыточно синтезированных цепей происходит в эритрокариоцитах костного мозга и эритроцитах периферической крови. Это вызывает повреждение клеточной мембраны и ускоренную гибель клеток. Дисбаланс синтеза глобиновых цепей ведёт к неэффективности эритропоэза, гемолизу эритроцитов и развитию гипохромной анемии различной степени тяжести. Обычно эти анемии нормохромные, гиперрегенераторные или регенераторные.
● Талассемии относят к количественным гемоглобинопатиям, структура цепей гемоглобина не изменена. Различают α- и β
● Подтверждение диагноза — измерение соотношения α- и β-цепей (в норме оно равно 1:1). Гомозиготная β-талассемия (большая талассемия) — очень тяжёлое заболевание. Гетерозиготная β-талассемия (малая талассемия) клинически менее значима.
Пароксизмальная ночная гемоглобинурия. Характерно появление соматической мутации полипотентной стволовой клетки. У потомков аномальной стволовой клетки (эритроцитов, лейкоцитов и тромбоцитов) определяют дефицит одного из семейств протеинов, связанных с клеточной мембраной. Небольшое снижение pH плазмы во время ночного сна ведёт к активации гемолиза и ночной гемоглобинурии. В почках накапливаются гранулы гемосидерина, их можно обнаружить в моче. Из-за повышенного выведения с мочой железа у таких пациентов часто выявляют дефицит железа. Диагностика основана на наличии повышенной чувствительности эритроцитов к лизису, опосредованному комплементом.
Приобретённые гемолитические анемии
Анемии, обусловленные экзоэритроцитарными факторами, — приобретённые, при них процесс эритропоэза не нарушен. Характерный внутрисосудистый гемолиз эритроцитов может иметь ауто- или изоиммунную природу, его вызывают механическое повреждение эритроцитов, лекарства, инфекционные агенты и иммунные реакции при инфекционных заболеваниях, гемолитические токсины, повышенная активность селезёнки.
Иммунные гемолитические анемии изоиммунного или аутоиммунного генеза проявляются некомпенсированным гемолизом — следствием иммунных реакций, направленных против изменённых или неизменённых антигенов эритроцитов.
● Аутоиммунные гемолитические анемии диагностируют преимущественно после 40 лет и у детей до 10 лет, при этом клетки иммунной системы синтезируют антитела к собственным неизменённым антигенам эритроцитов. Наиболее распространённая форма — аутоиммунная гемолитическая анемия, вызванная неполными тепловыми агглютининами. Заболевание может быть как идиопатическим, так и симптоматическим. Существуют анемия, ассоциированная с холодовым агглютинином, и анемия, ассоциированная с холодовым гемолизином (пароксизмальная холодовая гемоглобинурия). Симптоматические, или вторичные аутоиммунные гемолитические анемии развиваются на фоне лимфопролиферативных заболеваний и других злокачественных опухолей, инфекций, аутоиммунных заболеваний.
● Изоиммунные гемолитические анемии наиболее ярко представлены гемолитической болезнью новорождённых (фетальным эритробластозом) и трансфузионной гемолитической реакцией.
Маршевая гемоглобинурия — острое пароксизмальное заболевание, возникающее после долгих пеших переходов или длительного бега по твёрдой поверхности. Характерно механическое повреждение эритроцитов с развитием анемии. Травматическая фрагментация эритроцитов может возникнуть при прохождении через искусственные сердечные клапаны или повреждённые сосуды. Фрагментация эритроцитов и тромбоцитопения также бывают при микроангиопатической гемолитической анемии. Её наблюдают при тяжёлом гестозе у беременных, злокачественной артериальной гипертензии, тромботической тромбоцитопенической пурпуре и т.д.
Лекарственный иммунный гемолиз связан с синтезом антител к лекарствам или эритроцитам. Его вызывают различные препараты (пенициллины, хинидин, дигоксин, метилдопа, сульфаниламиды и т.д.).
Инвазия паразитов в эритроциты, вызывающая гемолитические нарушения, возможна при малярии и бартонеллёзе (лихорадке Ороя, или перуанской бородавке — болезни, вызываемой Bartonella bacilliformis в странах Южной Америки). У больных малярией гемолиз может быть внутри- и внесосудистым.
Анемии, вызванные гемолитическими токсинами, могут возникнуть при инфицировании патогенными бактериями (Clostridium welchii и Streptococcus pyogenes). Эти бактерии выделяют токсины, например, фосфолипазы, способствующие тяжёлому внутрисосудистому гемолизу. Гемолитические химикаты — фенилгидразин, соединения свинца, мышьяка и меди, сапонины (природные пенообразующие гликозиды), хлорат калия. При хронической интоксикации свинцом отмечают микроцитоз, пятнистую базофилию и гипохромию.
Анемия при гиперспленическом синдроме связана с повышенным разрушением эритроцитов в селезёнке.
