
- •Предмет стереохімії.
- •Що є предметом стереохімії?
- •Основні стереохімічні явища і поняття.
- •Питання для самоконтролю.
- •Способи зображення стереохімічної будови молекул
- •Номенклатура стерееоізомерів
- •Поворотна ізомерія. Конформації та конфомери.
- •Номенклатура конформаційних станів.
- •Фактори, що впливають на стан конформаційної рівноваги.
- •1. Просторова невалентна взаємодія наближених груп .
- •2. Диполь-дипольна взаємодія.
- •3. Утворення внутрімолекулярних водневих або асоціативних зв’язків.
3. Утворення внутрімолекулярних водневих або асоціативних зв’язків.
Нагадаємо спочатку умови утворення внутрімолекулярного водневого зв’язку: 1) необхідно мати протонований атом гідрогену (-O-H); 2) необхідно мати донора електронної пари (любий атом, що має неподілену пару електронів, подвійний або потрійний зв’язок, ароматичне ядро); 3) обидві ці групи повинні бути наближені в просторі.
В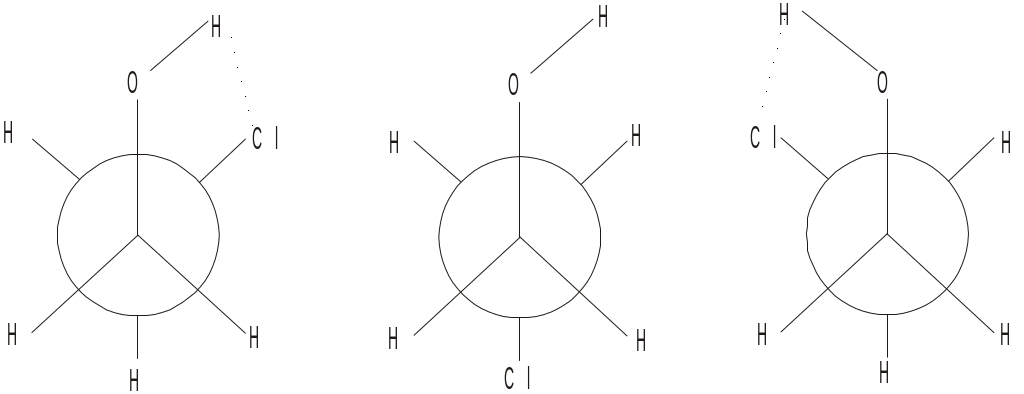 ізьмемо
для прикладу 2-хлоретанол-1 (HO-CH2-CH2-Cl).
Атом гідрогену у гідроксильній групі
є досить протонований, а в атома хлору
є три вільні пари електронів. Отже, при
певному розташуванні цих двох груп у
просторі може утворитися водневий
зв’язок.
Розглянемо конформери цієї сполуки.
ізьмемо
для прикладу 2-хлоретанол-1 (HO-CH2-CH2-Cl).
Атом гідрогену у гідроксильній групі
є досить протонований, а в атома хлору
є три вільні пари електронів. Отже, при
певному розташуванні цих двох груп у
просторі може утворитися водневий
зв’язок.
Розглянемо конформери цієї сполуки.
φ1 φ3 φ5
+sc ap -sc
Внутрішньомолекулярний водневий зв’язок може утворитися лише при синклінальному розташуванні гідроксильної групи та хлору. Енергія такого зв’язку 20 кДж/моль, що практично є рівновеликою величиною до енергії, яку потрібно подолати для повертання однієї частини молекули відносно іншої. Тому, утворення внутрішньомолекулярного водневого зв’язку стабілізує саме синклінальні конформації. У антиперіпланарній конформації може утворитись лише міжмолекулярний водневий зв’язок, який практично не впливає на стан конформаційної рівноваги.
Оскільки можливість утворення водневого зв’язку залежить від рН середовища, то і конформаційна рівновага в таких випадках теж буде залежати від рН. Розглянемо це на прикладі бурштинової (бутандіової) кислоти: НООС-СН2-СН2-СООН
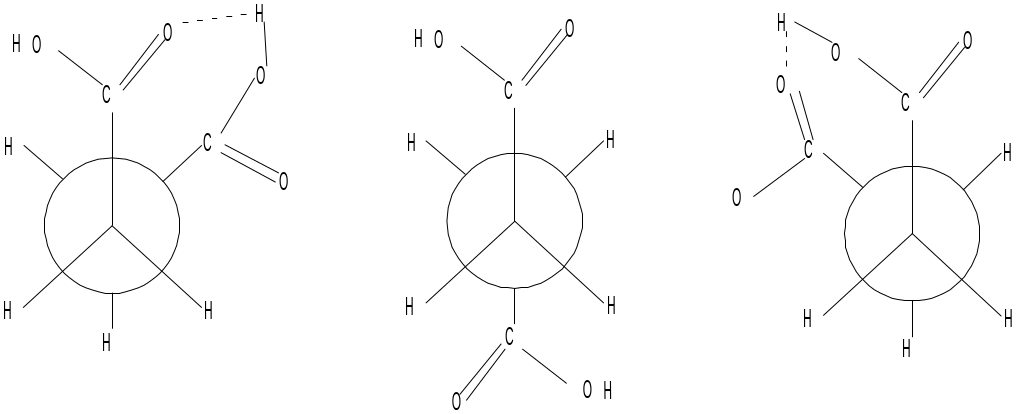 φ1
φ3
φ5
φ1
φ3
φ5
+sc ap –sc
Як бачимо, внутрішньомолекулярний водневий зв’язок може утворитися лише у φ1 та φ5. На малюнку показано як змінюється співвідношення конформерів φ1 та φ5 з одного боку і φ3 з іншого.
М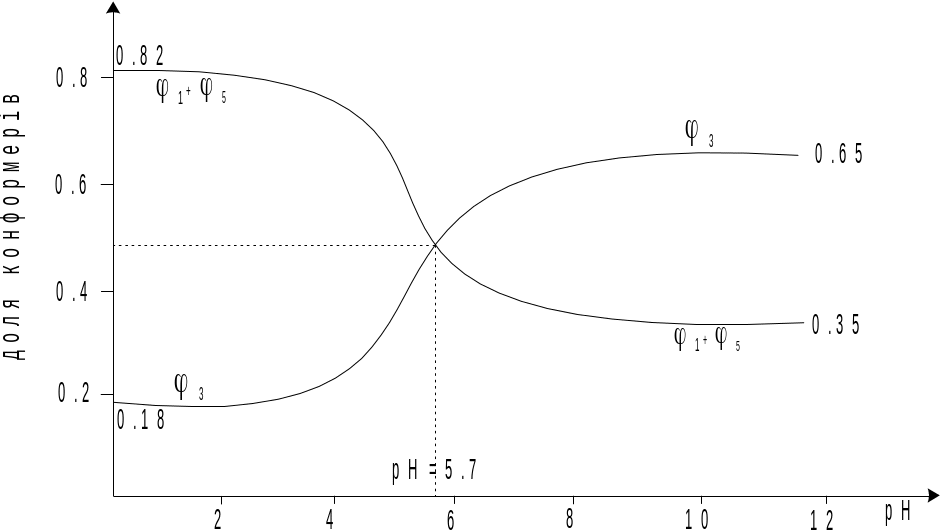 ал.
7. Вплив рН-середовища на стійкість
конформаційних станів бурштинової
кислоти.
ал.
7. Вплив рН-середовища на стійкість
конформаційних станів бурштинової
кислоти.
У сильнокислому середовищі дисоціація карбоксильних груп є пригнічена і тому тут можуть утворюватись водневі зв’язки. Причому, ймовірно утворюються два водневі зв’язки, по такій схемі: коли гідроксил першої групи утворює зв’язок з карбонільним оксигеном другої і навпаки. Тому вміст конформерів φ1 і φ5 є досить високий (0,52). При рН=5,7 одна з карбоксильних груп продисоціювала, а отже, може утворитися лише один водневий зв'’зок.

 Т
ут
конформаційна стійкість антиперіпланарного
конформера є вища приблизно у два рази,
ніж синклінального. В лужному середовищі
обидві карбоксильні групи існують у
формі аніонів, отже водневі зв’язки
взагалі не можуть утворитися. Ефекти
просторової та диполь-дипольної взаємодії
для синклінальних конформерів
дестабілізують ці стани, що ми реально
спостерігаємо на малюнку. Вміст φ3
сягає 0,65 а суміш φ1
і φ5
дає лише 0,35 долей.
Т
ут
конформаційна стійкість антиперіпланарного
конформера є вища приблизно у два рази,
ніж синклінального. В лужному середовищі
обидві карбоксильні групи існують у
формі аніонів, отже водневі зв’язки
взагалі не можуть утворитися. Ефекти
просторової та диполь-дипольної взаємодії
для синклінальних конформерів
дестабілізують ці стани, що ми реально
спостерігаємо на малюнку. Вміст φ3
сягає 0,65 а суміш φ1
і φ5
дає лише 0,35 долей.
