
- •Практикум по микробиологии
- •Часть 2. Микробиоценозы природных экосистем
- •Тема 1 микроорганизмы как часть экосистемы. Методы изучения микроорганизмов, входящих в состав микробиоценозов. Определение омч (кмафанм).
- •Микробиоценозы как часть экосистемы
- •Способы существования микроорганизмов в составе микробиоценоза
- •Методы изучения микроорганизмов, входящих в состав микробиоценозов
- •Идентификация микроорганизмов возможна при использовании системы классификации. Принципы современной систематики и классификации бактерий.
- •Определение общего микробного числа
- •Методика определения общего числа микроорганизмов омч (количества мафАнМ) бактериологическим методом
- •Методика выявления и определения количества термофильных и психрофильных микроорганизмов
- •Нормальная микрофлора кожи
- •Нормальная микрофлора дыхательных путей
- •Микрофлора разных отделов полости рта
- •Нормальная микрофлора пищевода
- •Микрофлора желудка
- •Микрофлора толстого кишечника
- •Микробиоценоз мочеполовой системы
- •Представители микробиоценоза организма человека и животных
- •Грамположительные кокки
- •Тема 3. Энтеробактерии
- •Коринебактерии, бактероиды, микобактерии
- •Модуль 6. Микрофлора пищевых продуктов и кормов.
- •Источники и пути обсеменения пищевых продуктов микроорганизмами
- •Особенности пищевых продуктов как среды обитания микроорганизмов
- •Особенности санитарно-микробиологического исследования пищевых продуктов
- •Тема 6 аэробные микроаэрофильные палочки и кокки семейств псевдомонады и ацетобактерии
- •Тема 7 молочнокислые палочки и кокки. Бифидобактерии.
- •Характеристика молочнокислых бактерий
- •Практическое значение молочнокислого брожения и молочнокислых микроорганизмов
- •Тема 8 Патогенные микроорганизмы в пищевых продуктах и кормах – листерии и иерсинии
- •Выявление и идентификация l. Monocytogenes при санитарно-микробиологических исследованиях
- •Выявление и идентификация Yersinia enterocolitica и Yersinia pseudotuberculosis
- •1 Этап. Предварительное холодовое обогащение в неселективной жидкой среде.
- •3 Этап. Выявление характерных колоний.
- •Санитарно-показательные микроорганизмы
- •Тема 9. Микробиоценозы объектов внешней среды Микрофлора воздуха. Санитарно-микробиологическое исследование воздуха.
- •Микрофлора воздуха
- •Санитарно-микробиологические исследования воздуха
- •Седиментационный метод (метод оседания) по Коху.
- •Аспирационный метод
- •Фильтрационный метод
- •Тема 10. Микроэкологические методы исследования почвы. Свободноживущие и симбиотические микроорганизмы почвы: – обитатели почвы
- •Условия обитания микроорганизмов в почве.
- •Антропогенное воздействие на почву
- •Экологические методы бактериологического исследования почвы.
- •Почвенные микроорганизмы, принимающие участие в круговороте азота
- •Свободноживущие и симбиотические азотфиксаторы семейств
- •Свободноживущие автотофные серо- железо- и марганецокисляющие почвенные бактерии
- •Грамположительные, не образующие спор палочки неправильной формы, род Arthrobacter.
- •Тема 11 санитарно-микробиологические методы бактериологического исследования почвы. Почвенные бациллы
- •Санитарно-микробиологическое исследование почвы
- •Бациллы
- •Сибирская язва
- •Диагностика сибирской язвы.
- •Тема 12 клостридии. Фузобактерии.
- •Ботулизм
- •Профилактика ботулизма
- •Столбняк
- •Газовая гангрена
- •Фузобактерии
- •Тема 13 обитатели почвы - актиномицеты и родственные им микроорганизмы
- •Тема 14 свободноживущие водные микроорганизмы – автотрофы
- •Тема 15 санитарно-микробиологическое исследование воды
- •Санитарно-микробиологическое исследование воды
- •Тема 16 водные микроорганизмы возбудители болезней
Определение общего микробного числа
Важным методом исследования микробиоценозов является определение общего микробного числа. Большое значение имеет определение этого показателя при санитарно-микробиологических, экологических исследованиях, в биотехнологии.
Общее микробное число (ОМЧ) – это общее количество микробов, содержащихся в единице объема или массы исследуемого объекта (1 мл воды, 1 г почвы, 1 м 3 воздуха). |
Существует три метода определения ОМЧ.
Оптический метод прямого подсчета бактерий под микроскопом в камере Горяева (используют при оценке работы очистных сооружений на водопроводных станциях).
Измерение биомассы (проводят в лабораториях предприятий биотехнологической промышленности)
Бактериологический метод (менее точный, но наиболее часто применяемый).
Бактериологическим методом выявляют определенную физиологическую группу бактерий, растущих при тех или иных условиях (термофильные, мезофильные, психрофильные, аэробные, анаэробные, факультативно анаэробные). Например, при культивировании на простых плотных питательных средах (МПА) при доступе кислорода воздуха и температуре 37оС можно выявить рост группы мезофильных аэробных и факультативно-анаэробных микроорганизмов (МАФАнМ).
В настоящее время принято считать, что при использовании бактериологического метода ОМЧ – это общее количество видимых при двукратном увеличении мезофильных (имеющих температурный оптимум+37оС) аэробных и факультативно анаэробных микроорганизмов (МАМ и ФАнМ), которые способны образовывать колонии на питательной среде при температуре +37оС в течение 24 ч. При обычных, стандартных исследованиях ОМЧ=КМАФАнМ. |
Методика определения общего числа микроорганизмов омч (количества мафАнМ) бактериологическим методом
Основные этапы определения ОМЧ (КМАФАнМ) бактериологическим методом:
гомогенизация образца,
десорбция микроорганизмов с плотных частиц,
приготовление разведений,
посев на питательные среды,
подсчет микробных колоний и идентификация выделенных культур.
Гомогенизацию образца проводят для равномерного распределения бактерий в анализируемом объекте. При исследовании проб различной консистенции, в зависимости от характеристик испытуемого материала, используют перемешивание простым встряхиванием или специальные приборы.
Десорбция бактерий с плотных частиц необходима для анализа объектов плотной консистенции. Для этого материал суспензируют в жидкости или с поверхности объекта берут смывы и отпечатки. При суспензировании к навеске образца массой 10 г (10 см3) добавляют 90 см3 воды и интенсивно перемешивают (вручную или в гомогенизаторе). В дальнейшем условно принимают 1 см3 полученной суспензии эквивалентным 0,1 г исходного материала.
Приготовление разведений чаще всего проводят, используя метод 10-кратных разведений, когда концентрация микроорганизмов каждого последующего разведения в 10 раз меньше предыдущего.
В стерильные пробирки с соблюдением правил асептики разливают по 9 см3 стерильной воды или специального раствора (физиологического раствора хлорида натрия, пептонной воды).
Из исследуемой пробы стерильной градуированной пипеткой отбирают 1 см3 жидкости (суспензии). Нельзя погружать пипетку в жидкость более чем на 3 мм во избежание в дальнейшем смывания микроорганизмов с ее наружной поверхности. 1 см3 жидкости (суспензии) переносят в пробирку с 9 см 3 жидкости для разведения. Получают разведение 1:10 (10-1). Новой стерильной пипеткой(!) тщательно перемешивают содержимое пробирки путем многократного заполнения и опорожнения пипетки. Этой же пипеткой набирают 1 см3 исследуемой жидкости (суспензии) в разведении 1:10 и переносят во вторую пробирку с 9 см3 стерильной дистиллированной воды; получают разведение 1:100 (10-2). Третьей стерильной пипеткой перемешивают содержимое второй пробирки и 1 см3 разведения вносят в третью пробирку с 9 см 3 жидкости для разведения; получают разведение 1:1000 (10-3). Эти манипуляции повторяют до получения необходимого ряда разведений.
Рисунок 1
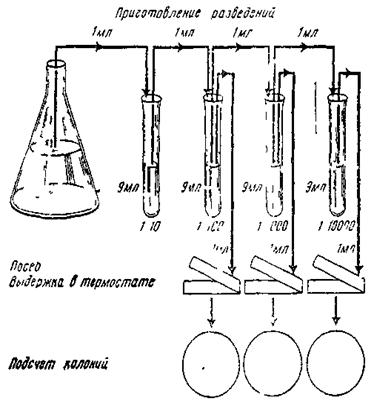
Посев на питательные среды проводят, используя методы глубинного и поверхностного посева.
а) Метод глубинного посева используют в случаях, когда идентификация микроорганизмов не требуется или же когда селекцию (выделение) той или иной группы микроорганизмов можно осуществить с помощью режима инкубации. В 2-3 и более пустые стерильные чашки Петри, соблюдая правила асептики, вносят по 1 см3 жидкой пробы, суспензии, а также приготовленного разведения. Чашки предварительно маркируют со стороны донышка, чтобы исключить их случайную замену при сдвиге. Не позднее чем через 15 мин после внесения материала в каждую чашку вливают по 10-12 см3 расплавленной и охлажденной до 45°С агаризованной питательной среды (МПА) так, чтобы толщина получившегося слоя была 4-5 мм. Вращательными движениями перемешивают расплавленную среду и посевной материал, чтобы микроорганизмы равномерно распределились в массе среды. Чашки Петри оставляют на рабочем столе 10-15 минут для застывания. После застывания среды чашки переворачивают вверх дном и помещают в термостат для инкубирования. Оптимальным является, как правило, термостатирование при 370С в течение 24-48 ч. Затем приступают к подсчету колоний, выросших на поверхности и в глубине агара.
б) Метод поверхностного посева.
В тех случаях, когда после подсчета колоний может возникнуть необходимость в выделении чистой культуры и ее идентификации для определения количества жизнеспособных микроорганизмов, используют метод поверхностного посева. Питательную среду разливают в чашки Петри и после застывания подсушивают, переворачивая чашки вверх дном и выдерживая их открытыми в термостате 30 мин при температуре 37о С (или в ламинарном боксе 1-2 ч). В центр маркированной чашки Петри вносят заданное количество (чаще всего 0,1 или 0,2 см3) исследуемого жидкого материала или его разведения и немедленно равномерно распределяют по поверхности среды стерильным стеклянным или пластиковым шпателем до тех пор, пока на агаре не останется видимых следов жидкости. Чашки с посевами переворачивают, помещают в термостат, установленный на соответствующий температурный режим.
Подсчёт микробных колоний проводят сразу же после извлечения чашек из термостата, а если это невозможно, их хранят в холодильнике не более 24 ч. При подсчете колоний учитывают рост микроорганизмов только с заданными культуральными свойствами, а при использовании элективных сред – с соответствующими биохимическими характеристиками.
Колонии микроорганизмов подсчитывают визуально или при помощи лупы с 2-5-кратным увеличением. Чашку вверх дном кладут на черный лист бумаги, каждую подсчитанную колонию отмечают со стороны дна чашки карандашом или маркером для стекла. Желательно оценивать только те разведения, при посеве которых на чашках вырастает от 30 до 300 колоний (а при посеве нативного материала – от 1 до 300 колоний). Если большое количество колоний трудно подсчитать, то с помощью стеклянной пластинки с сеткой со стороной квадрата 1 см подсчитывают колонии в разных местах чашки в 20 квадратах площадью 1 см2, выводят среднее арифметическое в одном квадрате и умножают на площадь чашки в сантиметрах. В специализированных лабораториях используют специальные приборы - специальные ручки-счетчики, счетные камеры, счетчик колоний бактерий, с помощью которого подсчет колоний осуществляется за 0,2 сек. Результат определения КМАФАнМ выражают числом КОЕ (колониеобразующих единиц) в 1 см3 пробы.
Чтобы результаты выразить количеством микробов в 1 см3 исследуемого объекта или продукта, число выросших на чашке колоний умножают на степень разведения пробы и вычисляют среднее арифметическое количество колоний, подсчитанных на двух чашках.
