- •Кафедра земледелия и агрохимии
- •Тема 1. Отбор и подготовка образцов для анализов
- •Проба и навеска
- •Отбор воды для анализа
- •Подготовка почвенных образцов к анализу
- •1.4. Подготовка семян к анализу
- •1.5. Подготовка вегетативных органов к анализу
- •1.6. Подготовка свежеубранных растений к анализу
- •Тема 2. Спектральные методы анализа
- •2.1. Теоретические основы
- •2.2. Фотометрические методы анализа
- •2.2.1. Фотоколориметрические методы анализа
- •Определение концентрации вещества в растворе на фотоэлектроколориметре
- •2.3. Пламенная спектрофотометрия
- •Эмиссионный спектральный анализ (фотометрия пламени)
- •На пламенном фотометре
- •2.4. Атомно-абсорбционная спектроскопия
- •Определение подвижных форм микроэлементов в почвах методом атомно-абсорбционной спектроскопии
- •2.5. Люминесцентный анализ
- •2.6. Современные приборы спектральных методов анализа Анализатор жидкостей «Флюорат – 02-3 м»
- •Процедура работы
- •Области применения:
- •Устройство и работа анализатора
- •Метод «Фотометрия»
- •Измерение концентрации:
- •Измерение оптической плотности раствора:
- •Метод «Хемилюминесценция»
- •Метод «Фосфоресценция»
- •Использование анализатора жидкости Флюорат 02-3м в качестве фотометра
- •Метод инструментального определения хпк
- •Нефелометрический метод определения мутности
- •Тема 3. Электрохимические методы анализа
- •3.1. Потенциометрические методы анализа Теоретические основы потенциометрии
- •Приборы для определения рХ ионов
- •Анализаторы жидкости многопараметрические экотест-2000
- •Устройство и принцип работы анализаторов. Принцип работы анализаторов
- •Измерение температуры
- •Измерение окислительно-восстановительного потенциала
- •Измерение концентрации кислорода
- •Подготовка анализаторов к работе
- •Подготовка контрольных растворов
- •Подготовка электродов
- •3.2. Кондуктометрические методы анализа
- •Теоретические основы кондуктометрического метода анализа
- •Кондуктометры кпц-026 Назначение
- •Устройство и принцип работы
- •Принцип действия кондуктометра
- •Индикация результатов измерения
- •Подготовка к работе
- •Проведение измерений кондуктометром
- •Измерение уэп погружным блоком датчиков
- •Измерение уэп проточным блоком датчиков
- •Практическое применение кондуктометрического метода анализа
- •Тема 4. Хроматография
- •4.1. Жидкостная адсорбционная хроматография
- •Аппаратура
- •Технические характеристики Характеристики модификаций «ЦветЯуза» 01,02,03,04:
- •Состав хроматографа
- •Устройство и работа
- •Устройство и работа «ЦветЯуза» 01-аа
- •Передняя панель хромактографа «ЦветЯуза»
- •Кондуктометрический детектор
- •Использование хроматографа «ЦветЯуза»
- •Подготовка хроматографа модификаций «ЦветЯуза» 01,02,03,04 к использованию Порядок подготовки рабочего места
- •Включение хроматографа
- •Меры безопасности при использовании хроматографа
- •Подготовка «ЦветЯуза» 01-аа к использованию Порядок подготовки рабочего места
- •Использование «ЦветЯуза» 01-аа
- •Список рекомендуемой литературы
- •400119, Г. Волгоград, ул. Тулака, д. 12.
Тема 3. Электрохимические методы анализа
Электрохимия, изучающая взаимосвязь между электрической энергией и химическими реакциями, находит в физико-химических методах анализа широкое применение. Электрохимические методы анализа основаны на использовании электрохимических процессов, происходящих в электролитической ячейке. Электролитическая ячейка представляет собой электрохимическую систему, состоящую из электродов и электролитов, контактирующих между собой.
Во всех электрохимических методах используют электрические параметры (сила тока, напряжение, сопротивление) как аналитический сигнал. Эти параметры не зависят от цветности растворов и агрегатного состояния. Данные методы применяют либо для прямых измерений, основанных на зависимости «аналитический сигнал - состав», либо для индикации конечной точки титрования в титрометрии. Электрохимические методы анализов позволяют определять концентрацию вещества в широком интервале (1-10-9 моль/л) с достаточной точностью и воспроизводимостью.
Из всех электрохимических методов наиболее широкое применение получили методы потенциометрии, кондуктометрии, кулонометрия и полягрография.
3.1. Потенциометрические методы анализа Теоретические основы потенциометрии
Потенциометрия представляет собой электрохимический анализ растворов электролитов, для определения активной концентрации элементов.
Применение данного метода дает возможность прямого и селективного определения большого числа элементов, иногда даже с дифференцией по валентности (NH4+ и NO3-, S2- и SO42-, Cl- и ClO4-).
Этот метод позволяет вести измерения в мутных и окрашенных растворах, пастах и даже в живых биологических объектах. Можно исследовать многокомпонентные смеси веществ без предварительного их разделения. Измерения выполняют очень быстро, что позволяет осуществлять непрерывный контроль за процессами. При автоматизации определения ведут в широких диапазонах концентраций. Эффективный рабочий диапазон составил 5-7 порядков, а для определения рН – около 16. Точность определения – 0,1%.
Многие соединения в растворах диссоциируют на катионы и анионы. Ионы и молекулы в растворах взаимодействуют друг с другом и проявляют свой свойства так, как будто концентрация их меньше чем в действительности. Для описания явления кажущегося снижения концентрации раствора Льюис ввел понятие активности.
Активность отличается от концентрации только тем, что в них входят силы взаимодействия, существующие в растворах и не зависящие от природы растворенных частиц, а также от их концентрации. Поэтому активность можно представить как произведение концентрации на некоторый переменный фактор, называемый коэффициентом активности, т.е.:
α = fС 1
где α – активность электролита (или его ионов);
С – аналитическая концентрация электролита;
f – коэффициент активности, включающий поправку на силу взаимодействия.
Активность определяется в единицах концентрации.
Коэффициент активности, как правило, бывает меньше единицы, и лишь при очень большом разбавлении раствора, когда силы взаимодействия между ионами приближаются к нулю, коэффициент активности становится равным единице. Степень отклонения коэффициента активности от единицы служит мерой отклонения раствора от идеального состояния.
Если коэффициент активности меньше единицы, активность ионов меньше их концентрации, получившийся при диссоциации растворенного вещества:
α < С 2
Активность ионов зависит не только от электростатического, но и от химического взаимодействия.
Для характеристики зависимости активности ионов от концентрации всех находящихся в растворе ионов Льюис ввел понятие об ионной силе раствора электролита. Ионной силой раствора электролита называется величина (μ), измеряемая полусуммой произведения концентрации (С) каждого из присутствующего в растворе ионов на квадрат их валентности (Z), то есть:
μ = |
1 2 |
i = 1 Σ i = n |
Zi2Ci 3 |
Недиссицоциированные молекулы, как не имеющие зарядов, в формулу подсчета ионной силы раствора не включаются.
С увеличением концентрации раствора сильного электролита количество ионов в растворе возрастает, что приводит к увеличению ионной силы раствора и значительному уменьшению коэффициента активности, а, следовательно, и активности всех ионов.
Для разбавленных растворов электролитов состава 1:1 с ионной силой до 10-3 М справедлив закон Дебая – Гюккеля:
lgf
= AZ2![]() 4
4
где А – константа зависящая от температуры и диэлектрической проницаемости раствора.
При больших концентрациях электролитов необходимо использовать более сложные уравнения.
Для проводников электролитического тока, металлов или растворов, характерно следующее: если два разных проводника привести в соприкосновение друг с другом, то носители электричества, электроны или ионы, будут распределяться между двумя фазами проводников. Распределение может оказаться неравномерным, т.е. в одной из фаз носителей электричества будет больше, а в другой меньше. В таком случае возникает потенциал на границе фаз.
В основе потенциометрических методов анализа лежит зависимость потенциала электрода от состава равновесного раствора, которую можно выразить уравнением Нернста:
е = е0 + RT / nF ▪ln aХ,
где е – электронный потенциал, мв;
е0 – нормальный потенциал, константа данного электрода;
Т – температура по Кельвину;
аХ – активная концентрация определяемых ионов;
n – их валентность;
R – общая газовая постоянная и F – постоянная Фарадея.
При переходе к десятичным логарифмам, взяв численное значение констант R и F при 250С, получим следующее уравнение:
е = е0 + 59 / n ▪ lg aХ. 6
Уравнение Нернста лежит в основе потенциометрических определений активной концентрации ионов. Для этого используют электрод, потенциал которого зависит от определяемых ионов (индикаторный электрод). Чтобы найти потенциал, исследуемый электрод соединяют с другим электродом, потенциал которого известен (электрод сравнения), и измеряют разность потенциалов, т.е. электродвижущую силу (ЭДС) гальванического элемента:
Е = еср – еХ Е = еср – (е0 + 59 / n ▪ lg aХ) (мВ) 7
или Е = еср – е0 – 59 / n ▪ lg aХ (мВ), 8
где еср и е0 – величина постоянная, обозначим их разность через Е0, тогда
Е = Е0 – 59 / n ▪ lg aХ (мВ). 9
Это уравнение показывает, что для определения активной концентрации исследуемого иона достаточно измерить ЭДС цепи (Е). Оно является уравнением прямой. Коэффициент 59/n называется крутизной, он применим для 250С. При других температурах он уточняется температурным коэффициентом крутизны, равным 0,1984 для одновалентных ионов и 0,992 для двухвалентных ионов, на каждый градус. Отсюда ЭДС элемента зависит от активности соответствующего иона и температуры раствора.
Для аналитика самым интересным, несомненно, представляется возможность непосредственно определять активность или концентрации определенного вида ионов в результате измерения равновесного гальвани – потенциала соответствующего электрода. Измерения такого типа относятся к области прямой потенциометрии.
Потенциал одного, отдельно взятого электрода измерить практически невозможно. Цепь для измерений составляется минимум из двух электродов, один из которых – электрод сравнения который имеет заранее известный и постоянный скачок потенциала. Электрод сравнения осуществляет контакт между раствором и клеммой измерительного прибора. Вторая клемма прибора соединяется с индикаторным электродом.
Например, при измерении рН раствора можно использовать цепь из водородного и каломельного электрода.
В качестве электродов сравнения используют: стандартный водородный хлориднортутный (каломельный), таламидный и хлорсеребряный.
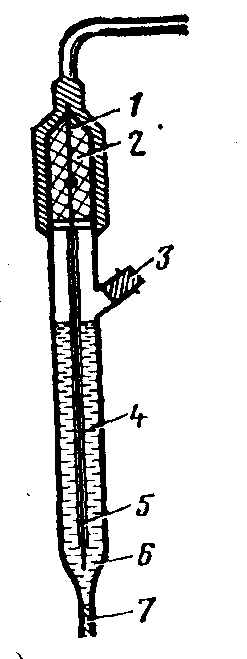
|
Рисунок 16 – Устройство хлорсеребряного электрода ЭВЛ-1М3: 1 – серебряная проволока; 2 – кристаллы AgCl, резиновая пробка и отверстие для залива раствора KCl; 4 – раствор KCl; 5 – асбестовая нить; 6 – корпус; 7 – капилляр |
Наша промышленность выпускает хлорсеребряные электроды ЭВЛ-1М3, ЭВЛ-1М1.
Индикаторными называют электроды, потенциал которых зависит от активности определяемых ионов в исследуемом растворе.
Наиболее широко используется в лабораторных исследованиях два основных класса индикаторных электродов.
Электроды на межфазных границах которых протекают реакции с участием электронов, называют электрообменными, например, окислительно-восстановительные электроды.
Электроды на межфазных границах которых протекают ионообменные реакции, называют ионообменными, мембранными, а также ионоселективными.
Ионоселективные электроды позволяют специфически и количественно определить очень большое число веществ, в том числе простые неорганические ионы, аминокислоты и сложные органические соединения.
Широкие возможности применения, небольшой расход исследуемого вещества, а также простота процесса измерения ставят ионоселективные электроды не только в центре внимания, но и позволяют использовать в качестве вспомогательных средств в исследованиях по физиологии, медицине, биологии, геологии, при изучении окружающей среды и т.д.