
Теория двойного электрического слоя
Для описания явлений, обусловленных существованием ДЭС, необходимо провести более детальное рассмотрение его структуры и получить количественные выражения, связывающие скачок потенциала с величиной поверхностного заряда (0).
Рис. 4. Плотный слой Гельмгольца. |
Первая количественная теория ДЭС была разработана Гельмгольцем (1879 г.) и Переном. В то время о существовании ионов в растворах не знали и рассматривали ДЭС как плоский конденсатор, внешняя обкладка которого расположена в жидкости параллельно поверхности на расстоянии молекулярного порядка от нее (рис. 4). Потенциал , отсчитанный от нулевого уровня, отвечающего глубине раствора (x = ), = ()x - ()x = уменьшается линейно с расстоянием x от поверхности, в соответствии с теорией плоского конденсатора. |
Согласно современным представлениям (развитым в 1910 г. и основанным на идее подвижности ионов внешней обкладки в работах Гуи и Чепмена), распределение этих ионов в пространстве определяется двумя противоположными тенденциями: электростатическим притяжением, удерживающим противоионы у поверхности, и тепловым движением (диффузией) этих ионов, выравнивающим их концентрации в поверхностном слое и объеме.
Устанавливающееся равновесное распределение (порядок беспорядок) образует вблизи поверхности раствора «облако» электрических зарядов с убывающей плотностью, совершенно аналогичное распределению плотности газов в атмосфере или седиментационному равновесию.
Равновесные концентрации катионов (с+) и анионов (с-) в поверхностном слое и в объеме раствора представлены схематически на рис. 5 для отрицательно заряженной поверхности, к которой, для большей определенности, мы будем часто относить последующие рассуждения (справедливые, с учетом знака, и для положительно заряженной поверхности).
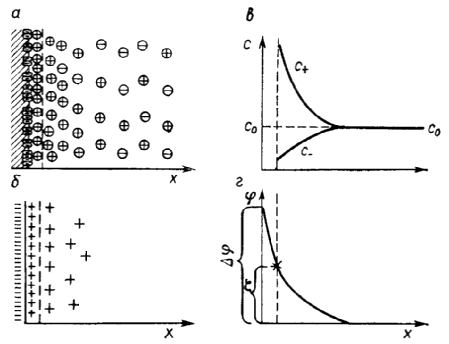
Рис. 5. Схема двойного электрического слоя:
а — распределение ионов; б — схематическое изображение избыточных ионов;
в — концентрации ионов на различных расстояниях от поверхности;
г — распределение потенциала.
Слой раствора с измененными концентрациями ионов вблизи поверхности называется диффузным. Этот термин показывает, что причина пространственной размытости слоя — диффузия. В зависимости от условий, его толщина изменяется на несколько порядков — от ангстрем до сотен микрометров.
Теория Гуи, устанавливающая связь между зарядом, потенциалом и концентрацией электролита в растворе, в своем основном варианте рассматривала ионы, как точечные заряды, могущие подходить неограниченно близко к поверхности. Недостаточность этого представления оказалась причиной того, что некоторые экспериментальные факты (например, значения электрической емкости) не укладывались в рамки теории.
Рассмотрим теорию Гуи в ее модифицированной форме, учитывающей конечные размеры ионов (Штерн). В этой форме она используется в большинстве современных работ, не будучи вытесненной более новыми представлениями, и позволяет количественно интерпретировать большой экспериментальный материал, особенно в области разбавленных растворов.
Внешнюю обкладку можно разделить на два слоя: плотный слой ионов, приближенных вплотную к поверхности, и диффузный.
Строение плотного слоя зависит от того, сохраняется ли гидратная оболочка иона при его адсорбции или же ион частично дегидратирован. Толщину плотного слоя d определяют как расстояние от поверхности (точнее, от центра тяжести зарядов внутренней обкладки) до плоскости, проходящей через центры ближайших к поверхности противоионов. Эту плоскость называют плоскостью наибольшего приближения ионов. Толщина d имеет порядок единиц ангстрем.
Рис. 6. Распределение потенциала в двойном электрическом слое. |
Падение потенциала с расстоянием во внешней обкладке изображено на рис. 6. Оно отличается от рассмотренного выше (рис. 4) тем, что имеет линейный характер лишь в плотном слое. Действительно, если считать заряд сосредоточенным в центре иона, то в слое толщиной d свободные заряды отсутствуют. При x d, в области диффузного распределения, существует объемный заряд, и изменяется с ростом x нелинейно. |
Обозначим значения потенциала через 0 - на поверхности твердой фазы и 1 - в плоскости наибольшего приближения.
Рассмотрим зависимость от x и связь между величиной поверхностного заряда 0 и .
Концентрация ионов вблизи поверхности определяется законом Больцмана
![]()
где ci – концентрация i-го иона в области поверхностного слоя, c0 – в объеме раствора; z – заряд иона (включающий и знак); F – число Фарадея.
Выразим через ci объемную плотность заряда ():
![]()
Свободный заряд складывается из избытка противоионов и недостатка ионов, заряженных одинаково с поверхностью (коионами). Заряд в каждой точке равен фактически разности (формально их сумме) концентраций противоионов и коионов (умноженных на ziF — коэффициент перехода от «химических» единиц к «электрическим»).
Считаем, что радиус кривизны поверхности много больше толщины поверхностного слоя (R >> ). В этом случае для уже плоского ДЭС
![]()
а для плотности поверхностного заряда (0):
![]()
Уравнение Гуи выражает плотность поверхностного заряда 0 как функцию безразмерного потенциала 1 (или потенциала 1) в плоскости наибольшего приближения ионов и равновесной концентрации электролита в растворе с. Этот потенциал на внешней границе плотного слоя играет большую роль в коллоидной химии.
Последние уравнения учитывают лишь кулоновское взаимодействие противоионов с ионами внутренней обкладки и не учитывают специфической адсорбции противоионов под действием некулоновских (вандерваальсовых) сил. Это специфическое взаимодействие, характерное для адсорбции многозарядных ионов, ионов красителей, алкалоидов, ПАВ, рассматривается в теории Штерна (1924 г.).
Штерн вводит понятие адсорбционного потенциала иона i, выражающего изменение потенциальной энергии системы при переносе 1 г-иона вещества из глубины раствора в поверхностный слой при 1 = 0, т. е. в отсутствие электрического поля.
Таким образом, i выражает дополнительную (к кулоновской) энергию адсорбции иона (отрицательные значения, отвечают притяжению, положительные — отталкиванию).
Упрощенное уравнение теории Штерна:
![]()
Учитывая принцип электронейтральности
![]()
где 0 — плотность заряда в плотном слое (слой Штерна в случае специфической адсорбции); 2 — плотность заряда в диффузном слое.
или
![]()
В полученном сложном
выражении для
0 (1)
первый член
изменяется
линейно
с c,
второй —
изменяется линейно
с
![]() .
Это означает, что
по мере увеличения
с
в растворе должен
возрастать относительный вклад заряда
плотного слоя в величину заряда внешней
обкладки.
.
Это означает, что
по мере увеличения
с
в растворе должен
возрастать относительный вклад заряда
плотного слоя в величину заряда внешней
обкладки.
Величина получила название приведенной толщины диффузного слоя. Ее смысл означает, что реальный диффузный слой эквивалентен такой модели, в которой все противоионы отстоят на одинаковом расстоянии от плоскости x = d.
представляет собой такое расстояние (от плоскости наибольшего приближения), на котором (x) в e раз меньше 1 (см. рис. 6) и не зависит ни от плотности поверхностного заряда 0, ни от потенциала (0 или 1), а является функцией лишь заряда ионов и концентрации электролита (при Т = const).
Диффузный слой в разбавленных растворах простирается на расстояния порядка тысяч ионных радиусов в глубину раствора. В неводных, особенно в неполярных средах, где концентрации ионов ничтожны (вследствие незначительной диссоциации), значения могут составлять сотни и даже тысячи микрометров (для высокоочищенных углеводородов).
Перейдем к рассмотрению зависимости величины 1 от с и zi весьма важной для решения многих теоретических и практических вопросов.
С ростом концентрации электролита в растворе 1 уменьшается, и тем сильнее, чем выше z; при этом происходит «сжатие» диффузного слоя (уменьшение толщины ).
При c весь скачок потенциала приходится на плотный слой, тогда как за его пределами, в растворе, свободный заряд диффузного слоя и скачок потенциала отсутствуют ( = 0) в ДЭС приобретает структуру слоя Гельмгольца (см. рис. 4).
В растворах содержащих потенциалопределяющие ионы наблюдается такое же сжатие диффузного слоя и уменьшение 1 с ростом с, однако наряду с этим происходит увеличение 0 (вследствие адсорбции), а, следовательно, и 1, особенно заметное в области изоэлектрической точки (ИЭТ).
Теория ДЭС, широко используемая для интерпретации поверхностных явлений, нуждается, как и всякая теория, в экспериментальной проверке. Однако мы не имеем возможности измерить 1 непосредственно, прямыми методами. Таким образом, 1 принадлежит к разряду строго определенных, но практически неизмеримых величин. Можно, однако, измерить другую, близкую к 1 величину — электрокинетический потенциал , называемый кратко дзета-потенциалом. Эта величина является менее определенной, но зато измеримой на опыте.
Дзета-потенциал определяют как потенциал ближайшей границы (к поверхности частицы) скольжения фаз, отсчитываемый от уровня в жидкой фазе, достаточно удаленного от границы раздела.
Граница скольжения устанавливается при относительном перемещении фаз, например при течении жидкости вдоль твердой: поверхности. Мы не знаем точно, где она проходит по отношению к ДЭС. Можно с достаточной уверенностью предполагать, что первый слой ионов со своими гидратными оболочками и первый слой молекул воды, смачивающих твердую фазу, не перемещаются относительно твердой фазы при течении жидкости. Поэтому следует полагать, что граница скольжения проходит либо на расстоянии d от поверхности, и в этом случае = 1 , либо смещена глубже в жидкую фазу, оставляя часть ионов диффузного слоя в гидродинамически неподвижном слое жидкости; в. этом случае < 1 . Различие между и 1 должно быть тем менее заметной в области разбавленных растворов.
В первом приближении можно считать, что = 1 . Теоретические закономерности, предсказанные для 1 , хорошо подтверждаются па опыте в отношении -потенциала.
Перейдем к рассмотрению электроповерхностных явлений, связанных с относительным перемещением фаз и называемых, поэтому электрокинетическими.


