
Моющее действие
На способности коллоидных коллоидных ПАВ мицеллярно растворять нерастворимые вещества и основано их моющее действие.
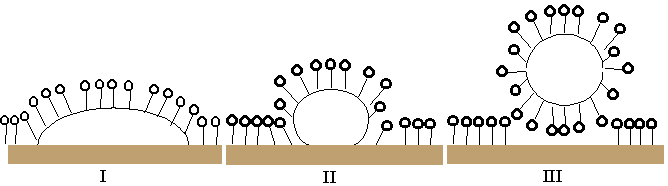
Рис. 3. Схема моющего действия ПАВ.
Как видно из рис. 3, на первой стадии происходит адсорбция молекул ПАВ на поверхности как материала, так и загрязнения (I). Далее из-за большей адсорбирующей способности частица неполярной «грязи» сначала приобретает форму близкую к сферической (II), а затем и отрывается от поверхности (III).
Обратимость коагуляции. Пептизация
Лиофобные системы могут значительно отличаться по своим свойствам в зависимости от степени их лиофилизации. Особенно проявляется это различие при изучении их обратимости – способности коагулированных систем к пептизации. Пептизацией (или дезагригацией) называется процесс, обратный коагуляции, а именно переход коагулята в золь. Этот процесс отличается от диспергирования твердой фазы тем, что энергия затрачивается на работу против межмолекулярных сил (а не химических сил) и затраты на увеличение поверхности раздела фаз при этом не происходит.
Пептизация тем более вероятна, чем более лиофилизирован исходный золь и чем меньше времени прошло с момента коагуляции, т.к. с течением времени при ближнем взаимодействии происходит срастание частиц с уменьшением дисперсности и поверхностной энергии.
Способ практического поведения пептизации зависит от причин, вызвавших коагуляцию. В случае концентрационной коагуляции, наступающей при c > cк , следует отмыть коагулят от электролита водой (использую декантацию, фильтрацию или диализ). Примеры такой пептизации – помутнение фильтрата при длительном промывании осадков As2S3 или на фильтре водой. В случае адсорбционной коагуляции, связанной с уменьшением потенциала на границе плотной части ДЭС (иногда до ИЭТ), необходимо повысит поверхностный заряд путем добавления электролита, содержащего потенциалопределяющие ионы. Например, амфотерные коагуляты типа Al(OH)3 пептизируются при добавлении кислот и щелочей в количествах c << cк , но достаточных для увеличения . Осадки типа AgI пептизируют добавлением умеренных количеств AgNO3 или KI.
Таким образом, коагуляции (слипание) представляет собой процесс, характеризующиеся относительной обратимостью.
Лиофобные системы
Лиофобные коллоиды, наоборот, характеризуются энергией связи внутри дисперсной фазы (Wc), значительно большей, чем энергия межфазного взаимодействия (Wa), и эта разность не компенсируется энтропийным фактором; для них:
![]()
Диспергирование не может идти самопроизвольно и совершается либо за счет внешней работы, либо за счет других процессов, протекающих в системе спонтанно (например, химических). Образующиеся дисперсии термодинамически неустойчивы и характеризуются высокими значениями на межфазной границе, которая соответствует малой величине Wa.
Системы, не диспергирующиеся самопроизвольно (F > 0), определяются как лиофобные коллоиды, хотя и для них всегда характерна та или иная степень межфазного взаимодействия (лиофилизации).
Несмотря на термодинамическую неустойчивость (F > 0), многие лиофобные коллоидные системы оказываются вполне устойчивыми кинетически, не изменяясь заметно в течение длительного времени (иногда десятилетиями). Очевидно, что эти системы существуют в метастабильном состоянии, т.е. потенциальный барьер для них достаточно высок.
Для уяснения причин относительной устойчивости подобных систем следует определить прежде всего, о каком виде устойчивости идет речь. Понятие о различных видах устойчивости — седиментационной (кинетической) и агрегативной — было введено Песковым.
Седиментационной называется устойчивость дисперсной фазы по отношению к силе тяжести. Нарушение ее и, как следствие, разрушение системы (разделение фаз), может быть вызвано:
седиментацией частиц, характерной для грубодисперсных систем, приводящей к оседанию (или всплыванию) дисперсной фазы. Высокодисперсные системы — кинетически устойчивы; для них характерно установление седиментационного равновесия;
изотермической перегонкой мелких частиц вещества дисперсной фазы в более крупные с последующей седиментацией;
потерей агрегативной устойчивости в результате объединения частиц, приводящего к коагуляции дисперсной фазы.
Коагуляция — процесс слипания частиц, образования более крупных агрегатов с потерей седиментанионной устойчивости (или с образованием структурированной системы) и последующим разделением фаз — разрушением дисперсной системы.
Таким образом, агрегативная устойчивость может быть определена как способность системы к сохранению дисперсности и индивидуальности частиц дисперсной фазы. Образующиеся в результате потери агрегативной устойчивости коагуляты представляют собой осадки (или всплывающие образования) различной структуры — плотные, творожистые, хлопьевидные, волокнистые, кристаллоподобные.
В лиофобных системах структура коагулятов и их прочность в значительной мере определяется степенью сольватации, которая может изменяться в весьма широком диапазоне — от типично лиофобных коллоидов (гидрозоли металлов) до систем сильно лиофилизированных, особенно в результате адсорбции ПАВ или ВМС. В подобных агрегатах, несмотря на изменение подвижности, частицы еще сохраняются как таковые большее или меньшее время (называемое временем жизни), после чего могут срастаться (в случае твердой дисперсной фазы) или сливаться (в случае жидкой) самопроизвольно с уменьшением поверхности раздела фаз. Срастание происходит в результате кристаллизации или конденсации; (слияние капелек называется коалесценцией).
Наблюдаемая долговечность многих лиофобных систем свидетельствует о том, что наряду с вандерваальсовыми силами притяжения между частицами в системе существуют и силы отталкивания или эффекты, экранирующие притяжение.
Многочисленные экспериментальные данные показывают, что в таких кинетически устойчивых типично гидрофобных системах всегда наблюдается заметный электрофорез. Прекращение его в силу тех или иных причин вызывает немедленную коагуляцию. Эта связь приводит к представлению об электрической природе сил отталкивания в типично гидрофобных системах, тем более, что увеличение концентрации электролита (уменьшающее 1 – и -потенциалы) всегда приводит к коагуляции.
В лиофилизированных и лиофильных системах явной связи между величиной -потенциала и устойчивостью не наблюдается; коагуляция вызывается десольватирующими агентами и дисперсные системы оказываются тем более устойчивыми, чем сильнее развиты сольватные оболочки.
На основании этих многочисленных, главным образом, качественных наблюдений можно говорить о двух факторах агрегативной устойчивости — об электростатическом барьере, обусловленном силами отталкивания, и о адсорбционно-сольватном барьере, который окружает частицу и препятствует ее сближению с другими частицами. Второй фактор доминирует в лиофилизированных системах и является весьма сильным, обеспечивающим устойчивость систем с высоким содержанием дисперсной фазы (имеющих наибольшее практическое значение). Следует отметить взаимосвязь обоих факторов, заключающуюся, прежде всего, в том, что увеличение заряда и потенциала поверхности способствует развитию сольватных оболочек и адсорбции стабилизаторов.
