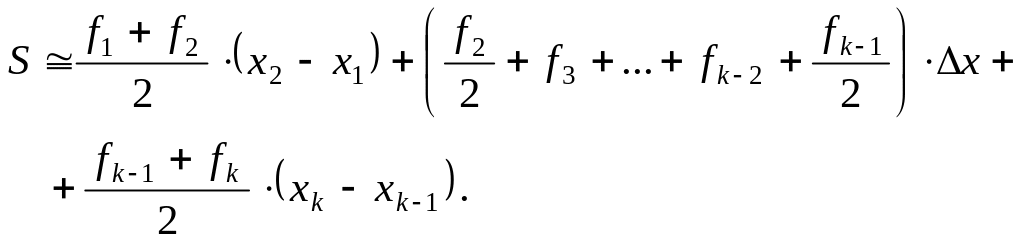- •Лабораторный практикум
- •Символы, наименования и единицы измерения основных физических величин
- •3.1. Разделение бинарной смеси жидкостей простой перегонкой
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •3.2. Разделение бинарной смеси жидкостей РектификациЕй Содержание работы
- •Цель работы: разделение жидкой бинарной смеси изопропанол – вода методом ректификации; определение качества (состава) дистиллята; расчёт коэффициента массопередачи по паровой фазе.
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •3.3. Коэффициент массоотдачи в жидкой фазе
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •3.4. Коэффициент массоотдачи в газовой фазе
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •3.5. Коэффициент массопередачи при конвективной сушке материала
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •3.6. Разделение раствора обратным осмосом
- •Рекомендации по выполнению работы
- •Рекомендации по обработке экспериментальных данных
- •Приложение Физические свойства воды на линии насыщения
- •Физические свойства сухого воздуха
- •Давление насыщенного водяного пара в зависимости от температуры
- •Равновесные составы жидкости (х) и пара (у) и температуры кипения (t) бинарной смеси изопропанол — вода
- •Условные обозначения контрольно-измерительных приборов на схемах лабораторных установок
- •Библиографический список
- •125047 Москва, Миусская пл., 9
Рекомендации по выполнению работы
Перед включением установки в работу убедиться, что кран К1 на линии отбора пробы полностью закрыт, а кран К2 на линии возврата дистиллята из сборника в куб-кипятильник полностью открыт.
1. Зафиксировать объём исходной смеси VF в кубе-кипятильнике.
2. Открыть полностью вентиль В1 на линии подачи воды в холодильник-конденсатор; приоткрыть на ⅓ оборота маховика вентиль В2 на линии подачи воды в обратный холодильник.
3. Включить тумблер подачи электропитания на спиральный нагреватель. Включить электропитание электронагревателя.
После того, как жидкая смесь в кубе закипит, выждать 7…10 минут, в течение которых достигается стационарный режим разделения.
4. Закрыть кран К2 на линии возврата дистиллята из сборника в куб-кипятильник.
Этот момент времени считается началом перегонки.
Отметить температуру кипения смеси tF в этот момент времени.
5. По истечении заданного времени перегонки отключить подачу электропитания на трубчатый электронагреватель. Незамедлительно зафиксировать температуру кипения смеси tW.
Отключить электропитание спирального нагревателя.
6. Через 20…30 минут, в течение которых дистиллят в сборнике охладится до комнатной температуры, зафиксировать объём дистиллята VD в сборнике и произвести отбор пробы дистиллята для определения его состава.
Для этого, открыв кран К1, слить в заранее подготовленный 1-й химический стакан вместимостью 100 мл не менее 50 мл дистиллята после чего кран К1 закрыть; стакан накрыть, например, листом бумаги во избежание испарения изопропилового спирта. Содержание изопропанола в этой жидкости, как правило, не адекватно среднему составу полученного дистиллята.
Затем налить несколько миллилитров дистиллята во 2-й химический стакан и незамедлительно определить содержание спирта в нём.
Концентрация изопропанола в дистилляте определяется по косвенному параметру – оптическому показателю преломления, измеряемому с помощью рефрактометра.
7. Открыть кран К2 и слить дистиллят из сборника С в куб-кипятильник К.
8. Вернуть в установку отобранные пробы дистиллята.
Для этого открыть заглушку З (пробку) и через воронку В слить содержимое обоих стаканов.
9. Отключить подачу воды в холодильник-конденсатор и в обратный холодильник, закрыв вентили В1 и В2.
Рекомендации по обработке экспериментальных данных
1. Определить молярные доли изопропанола в исходной смеси xF и в кубовом остатке xW.
Для этого по данным, представленным в таблице равновесных составов (см. с. 56), построить график зависимости состава жидкости от температуры кипения (для интервала 100,0… tF, °С) и, используя значения зафиксированных температур tF и tW, определить искомые концентрации.
2. Определить экспериментальное значение молярной доли изопропанола в дистилляте xD, эксп.
Для этого использовать измеренное значение показателя преломления дистиллята. Молярная доля х [в (моль С3Н8О)/(моль раствора)] и показатель преломления3 r водного раствора изопропилового спирта связаны соотношением:
х ехр (71,8504r − 99,7753) . |
(3.1.6) |
3. Определить количества исходной смеси nF и дистиллята nD, эксп по формуле (3.1.4).
Для этого использовать зафиксированные значения объёмов исходной смеси VF и дистиллята VD.
Плотность (в кг/м3) водного раствора изопропилового спирта при комнатной температуре может быть рассчитана по формуле:
(1,006410−3 + 3,82710−4х)−1. |
(3.1.7) |
При
расчёте по (3.1.5) молярной массы исследуемой
системы рекомендуется считать компонентом
А изопропиловый спирт, имеющий молярную
массу
![]() ,
а компонентом В — воду, молярная масса
которой
,
а компонентом В — воду, молярная масса
которой
![]() .
.
4. Рассчитать теоретическую концентрацию изопропанола в дистилляте xD, расч.
Полагая известными 3 параметра (xF, xW и nF) и решая систему уравнений (3.1.1)…(3.1.3) относительно xD, получают формулу для расчёта искомой концентрации:
|
(3.1.8) |
где
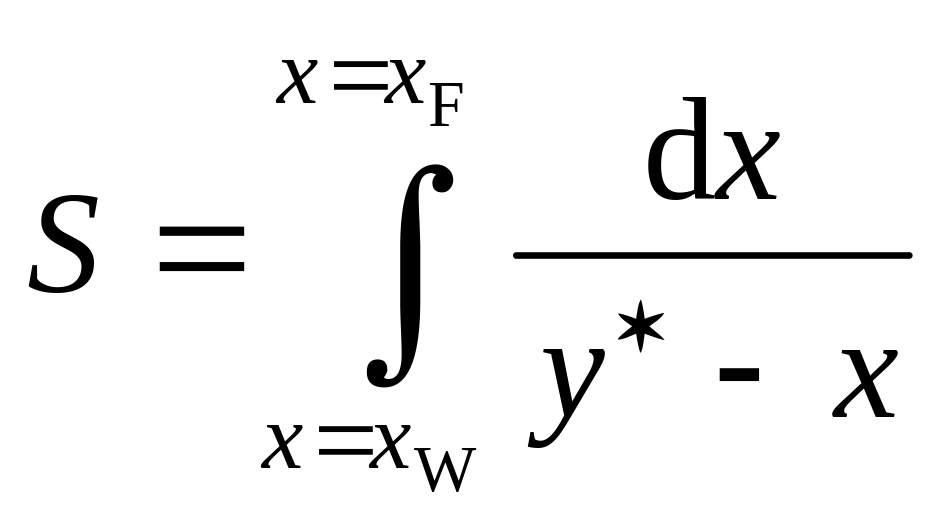 .
.
Для определения интеграла S рекомендуется предварительно вычислить значения интегрируемой функции f (у − х)−1 при различных значениях х, используя данные таблицы равновесных составов (см. с. 56). Значения у при x xW и x xF могут быть найдены линейной интерполяцией по известным ближайшим табличным величинам у. Величины х2…х k − 1 рекомендуется принять тождественными табличным. Подготовленную числовую информацию внести в таблицу:
№ п/п |
х·102, моль моль |
у·102, моль моль |
(х − у)·102, моль моль |
f |
1 |
[xW] |
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
… |
|
|
|
|
k − 2 |
|
|
|
|
k − 1 |
|
|
|
|
k |
[xF] |
|
|
|
Величина интеграла S, то есть площадь, ограниченная осью абсцисс, ординатами, проходящими через точки х xW и х xF, и кривой функции f, может быть определена по одной из квадратурных формул. Здесь рекомендуется применить формулу трапеций:
|
(3.1.9) |
При начальной концентрации раствора не более 0,04 моль/моль рекомендуется принять х 0,002 моль/моль соответственно шагу изменения концентрации (в интервале х 0,0…0,04 моль/моль) в указанной таблице. При xF > 0,04 моль/моль рекомендуется принять х 0,005 моль/моль.
5. Рассчитать теоретическое количество получаемого дистиллята nD, расч.
Решая систему уравнений (3.1.1)…(3.1.3) относительно пD, получают формулу для расчёта искомой величины:
|
(3.1.10) |
Измеренные и рассчитанные параметры рекомендуется занести в таблицу:
№ |
Исходная смесь |
Остаток |
|
||||||
VF, л |
tF, С |
xF, моль моль |
F, кг м3 |
MF, г_ моль |
nF, моль |
tW, С |
xW моль моль |
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
Дистиллят |
|||||||
|
VD, л |
r |
xD, эксп моль моль |
D, кг м3 |
MD, г_ моль |
nD, эксп моль |
xD, расч моль моль |
nD, расч моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Проанализировать значения количества и качества (состава) дистиллята, полученные экспериментально и рассчитанные теоретически, и сделать выводы по работе.