- •Тема№3. Протиінфекційний імунітет Імунітет і його основна функція
- •Загальна характеристика антигенів
- •Основні властивості речовин-антигенів
- •Антигени бактерій і вірусів
- •Антитіла (імуноглобуліни). Характеристика основних класів імуноглобулінів
- •Динаміка утворення антитіл
- •Теорії синтезу антитіл
- •Структура імунної системи організму
- •Антигенпрезентуючі клітини
- •Структура і функція головного комплексу гістосумісності
- •Генетична карта головного комплексу гістосумісності
- •Механізми захисту організму від збудників захворювань
- •Альтернативний шлях активації
- •Класичний шлях активації комплементу
- •Механізм імунного захисту організму
- •Імунні системи шкіри і слизових оболонок
- •Генетичні та ідіотипні механізми регуляції імунної відповіді
- •Класифікація гіперчутливості за Coombs I Gell
- •Основні клінічні алергічні проби
- •Способи гіпо - і десенсибілізації організму
- •Гіперчутливість сповільненого типу
- •Трансплантаційний імунітет
- •Аутоімунні реакції
- •Особливості протипухлинного імунітету
- •Імунодефіцитні стани. Дослідження імунного статусу людини. Імунокорекція Класифікація імунодефіцитів і їх характеристика
- •1. Імунодефіцити в-системи імунітету
- •2. Імунодефіцити т-системи імунітету
- •4. Вади системи фагоцитозу
- •5. Вади системи комплементу
- •Лікування імунодефіцитних станів
- •Дослідження імунного статусу організму
- •Оцінка гуморального імунітету - стану в-системи
- •1. Визначення концентрації імуноглобулінів у сироватці (тест Манчіні)
- •5. Кількісні тести визначення в-лімфоцитів
- •1. Шкірні проби гіперчутливості сповільненого типу
- •2. Стимуляція лімфоцитів in vitro
- •3. Кількісні тести визначення т-лімфоцитів
- •4. Визначення субпопуляцій т-лімфоцитів
- •5. Функціональна оцінка т-хелперів
- •7. Цитотоксична активність к- і пк-клітин
- •Принципи імунокорекції
Антитіла (імуноглобуліни). Характеристика основних класів імуноглобулінів
Імунна система організму безумовно необхідна для його виживання, без неї смерть від будь-якої інфекції була б практично неминучою. Але якщо навіть не приймати до уваги цієї життєво важливої функції, імунна система викликає подив як приклад винахідливості природи.
Елементи цієї системи - клітини і молекули - постійно і пильно оберігають від інфекцій організм. Вони пізнають майже нескінченну кількість різноманітних чужорідних клітин і речовин, відрізняючи їх від клітин і речовин власного організму. Коли збудник потрапляє в організм, вони виявляють його і мобілізують захисні механізми для його знищення. Вони "пам'ятають" кожного збудника, так що при повторному зараженні тим самим мікробом організм захищається більш ефективно, ніж першого разу. Крім цього все це робиться в рамках дуже скромного "оборонно го бюджету"- використовується тільки невелика частина геному і ресурсів організму. Найбільш критичний момент у процесі імунної відповіді - це пізнання, виявлення хімічного маркера, який властивий "чужому" агенту на відміну від "свого". Це завдання покладено на особливі білки, які відрізняються дивовижною різноманітністю молекулярної структури. Ці розпізнавальні білки імунної системи існують у мільйонах, можливо, мільярдах різних форм. "Індивідуальність" кожної такої молекули дозволяє їй знаходити специфічні чужорідні маркери, мішені.
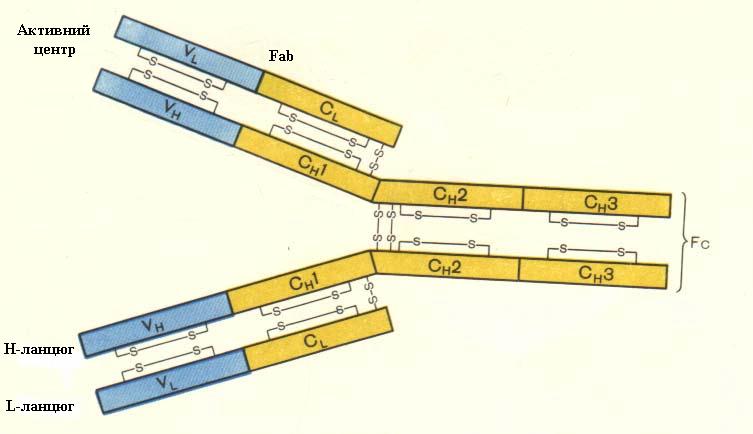
Найбільш відомими розпізнаючими білками є антитіла або імуноглобуліни (Ig). Існує п'ять класів імуноглобулінів людини - G, M, A, E, D. Молекули кожного класу складаються з важких і легких поліпептидних ланцюгів. Легкі поліпептидні ланцюги (L) бувають двох видів або g, або j і одинакові для всіх класів імуноглобулінів. Важкі ланцюги (Н) у кожного класу різні, і якраз від будови, назви важкого ланцюга і походить назва класу імуноглобулінів. Причому в імуноглобуліні в залежності від класу є одна або більше пар важких і легких поліпептидних ланцюгів, зв'язаних між собою дисульфітними зв'язками. У кожного імуноглобуліну є тільки один тип легких ланцюгів або g, або j. Таким чином, структурні формули кожного класу імуноглобулінів можна записати так: IgG - g2l2,, g2k2 , IgM - (m2l2)5, (m2k2)5, IgA - (a2l2)n , (a2k2)n, IgD - d2l2, d2k2 , IgE - e2l2, e2k2. У кожному класі імуноглобулінів розрізняють постійні ділянки - С(С - сonstat - постійний) і змінні V(variabile - варіабельний, змінний). Останні залежать від виду детермінантної групи антигену. Давайте на прикладі IgG більш детально розглянемо будову імуноглобуліну (рис. 7.5).
|
Рис. 7.5. Структура імуноглобуліну G. |
Постійні ділянки поліпептидних ланцюгів, спільні для одного класу антитіл, зумовлюють загальні властивості: здатність зв'язувати комплемент, фіксуватись на клітинних рецепторах, проходити через плаценту. Молекули імуноглобулінів складаються з компактних тісно скручених ділянок поліпептидних ланцюгів - доменів (глобул), які мають від 100 до 120 амінокислотних залишків. Між доменами одного ланцюга і доменами двох ланцюгів, які розміщені поряд, існує взаємодія. Як видно з малюнку IgG по довжині має 4 домени.
Кожен з доменів виконує певну біологічну функцію, що видно з малюнка. Vl , VH - зв'язує антиген, тут розміщений активний центр антитіла, СН2 - фіксує С1q, СН3 - забезпечує фіксацію на В-лімфоцитах, макрофагах, К-клітинах. Специфічність антитіла обумовлена відповідністю конфігура ції активного центру детермінантній групі антигена, що в свою чергу пов'язано з певною послідовністю амінокислот у варіабель них ділянках важких і легких ланцюгів. Активний центр - це щілина між варіабельними ділянками важкого і легкого ланцюгів імуноглобуліну. Функціонально він автономний, тому що здатний зв'язувати антигенну детермінан ту в ізольованому вигляді. У зв'язку з тим, що багато антигенних детермінант дуже подібні між собою за конфігурацією, один і той же активний центр може з'єднуватися з декількома детермінантами, які дещо різняться між собою. Доказом цього може бути той факт, що до однієї й тієї ж самої антигенної детермінанти постійно виявляють багато різновидностей антитіл. Імунні сироватки можуть містити у своєму складі декілька антитіл різної специфічності, хоча відомо, що існують високоспецифічні антитіла, які здатні розрізняти тільки конкретну антигенну детермінанту.
В університеті ім. Тафта в домені СН2 IgG виділено тетрапептид (289-292), який отримав назву тафтсин. Він має широкі біологічні властивості: стимулює фагоцитарну активність лейкоцитів, цитотоксичну дію Т-лімфоцитів і ін. У складі СН3 (341-344) виявлено пептид, який дістав назву ригін, що має властивості, подібні до тафтсину.
Поряд із активними центрами цілої молекули вивчені такі структурні ділянки, які відкриваються і починають проявляти свою активність лише після розщеплення антитіла (імуноглобуліну).
Якщо подіяти на імуноглобулін папаїном, то він розділяється на три частини: на два антигензв`язуючі фрагменти -Fab(fragment antigen binding) і один - здатний до кристалізації - Fc - фрагмент (fragment cristalisatione). Fab-фрагменти - це реально існуючі компоненти біологічного середовища в нормі і патології. Вони несуть на собі спеціалізовані структури, що виступають у ролі аутоантигенів і стимулюють синтез постійно циркулюючих антитіл - гомореактантів або аглютинаторів.
Fс-фрагмент імуноглобуліну також є імунорегуляторним фактором. Це чітко підтверджено відносно його дрібних пептидів, що утворюються після їх відщеплення протеазами.
Кінцевий пептид домена CH3 ( 23 амінокислотних залишки ) здатний активувати В-лімфоцити, підміняючи в цьому відношенн і активність Т-хелперів. Імуноглобуліни мають виражені антигенні властивості. Розрізняють 3 види антигенів: ізотипові, алотипові, ідіотипові. Ізотипові антигени ідентичні для всіх осіб даного виду. Алотипові антигени - внутрішньовидові - вони є в одних осіб даного виду і відсутні в інших. Ідіотипові детермінанти - властиві тільки антитілам, які синтезуються конкретним клоном плазматичної клітини. Характеристика імуноглобулінів різних класів
Клас імуноглобуліну, який синтезується на певний антиген, залежить від носія, а не від гаптену (детермінантної групи).
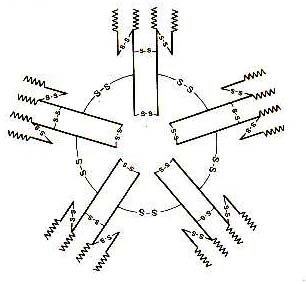
Імуноглобуліни класу М. (рис. 7.6)
|
Рис. 7.6. Структура імуноглобуліну М. |
Імунна відповідь організму розпочинається із синтезу IgM. Вони синтезуються швидко, але імунологі чна пам'ять у клітин, які їх синтезують або відсутня, або зберігається короткотривало. Період піврозпаду цього імуноглобуліну- 5 діб. Він містить додатковий ланцюг J, який об'єднує 5 мономерів в одну структуру. IgM має 10 активних центрів і додатковий домен СH4, який активно фіксує комплемент. Основним джерелом IgM є селезінка. IgM міститься в крові і секретах, чим, в основному, обумовлені бактерицидні властивості цих речовин. У жінок вміст IgM у сироватці значно більший, ніж у чоловіків, тому і бактерицидні властивості сироватки крові жінок набагато вищі. IgM має виражені гемолітичні властивості, що обумовлено зв'язуванням значної кількості комплементу. Імунітет проти збудників кишкових інфекцій в основному пов'язаний з цим класом імуноглобулінів, але вони не проходять через плаценту. Тому від матері новонароджені не отримують ці антитіла, і проти кишкових інфекцій вони беззахисні. У той же час нестача IgM компенсується за рахунок надходження в організм дитини IgM i IgA з молоком матері, ось чому так важливо годувати дитину материнським молоком.
IgM є так звані холодові аглютиніни, які спостерігаються в сироватці хворих холодовою алергією. Вони склеюють еритроцити при 40C. Це антитіла (аутоантитіла) до Fc-фрагменту IgG. Їх знаходять серед всіх класів імуноглобулінів (крім IgD), але найчастіше серед IgM.
Імуноглобуліни класу G. Після синтезу IgM настає більш високий етап імунної відповіді - утворення IgG. Цей клас імуноглобулінів продовжує синтезуватись протягом тривалого часу після попадання антигена і зв'язує не тільки корпускулярні антигени, але й розчинні, дрібні субстанції. Імунологічна пам'ять відносно цих антитіл зберігається довго, і у випадку необхідності організм може протягом короткого часу різко збільшувати кількість антитіл цього класу. IgG - основний клас імуноглобулінів, який складає 70 % всіх імуноглобу лінів. У значній мірі він виділяється у відповідь на повторне попадання антигену в організм. У процесі імунної відповіді відбувається переключення синтезу IgM на IgG. IgG порівняно термостабільні (витримують нагрівання при 75 0С 30 хв). При такій експозиції IgM швидко руйнуються. Період піврозпаду IgG - 23 доби. IgG нейтралізують віруси, токсини, опсонізуюче діють на бактерії, зв'язують комплемент. Їх активність по відношенню до токсинів у сотні разів вища, ніж у IgM. IgG - єдиний імуноглобу лін, який проходить через плаценту і захищає дитину в перший час після народження від збудників дифтерії, правця, коклюшу, кору тощо. За структурою важких ланцюгів серед IgG розрізняють чотири підкласи: IgG1, IgG2, IgG3, IgG4.
Імуноглобуліни класу А. За будовою виділяють сироваткові та секреторні IgА. Сироваткові IgA можуть мати структуру мономеру (80 % ), димеру або полімеру. В останніх двох є ще додатковий ланцюг J , який об'єднує ці мономери. Сироваткові імуноглобуліни А складають 10-20 % всіх імуноглобулінів сироватки.
Секреторні імуноглобуліни найчастіше бувають у вигляді димеру, до якого приєднується секреторний компонент (SP-фрагмент), який захищає IgA від руйнування протеазами. Секреторний імуноглобулін становить біля 1 % всього сироваткового IgA і складає основну частину імуноглобулінів, що виділяються на слизових оболонках. Значна кількість його міститься в слині, кишковому соку, молоці та інших секретах. Сироватковий мономерний IgA синтезують плазмоцити кісткового мозку, лімфатичних вузлів і селезінки, секреторний (S IgA) - плазмоцити лімфоїдної тканини слизових оболонок кишечника, верхніх дихальних шляхів, сечостатевої системи. Секреторний Ig A має виражені бактерицидні властивості. Він у декілька разів активніший по відношенню до грамнегативної флори, ніж IgM і в десятки разів в порівнянні із IgG.
S IgA - основний захисний фактор від вірусів й існує незалежно від сироваткового. Доведено, що місцева резистентність слизових від вірусних інфекцій тісно пов'язана з кількістю S IgA на слизових оболонках. Тому для максимального ефекту імунізації антигенами вірусів поліомієліту, грипу, парагрипу їх необхідно вводити на поверхню слизових кишечника чи, відповідно , верхніх дихальних шляхів.
S IgA, розміщуючись на поверхні слизових оболонок, захищає їх від адгезії на них патогенних мікроорганізмів. Є дані про те, що недостатня кількість IgA в організмі споріднена із схильністю до аутоімунних захворювань. Концентрація S IgA найвища у молозиві - 1500 мг/л, вмісті тонкого кишечнка - 750 мг/л, жовчі - 500 мг/л.
Імуноглобуліни класу Е. Ці імуноглобуліни одержали назву реагінів і відіграють основну патогенетичну роль в алергічних реакціях негайного типу. IgE синтезуються у шкірі, лімфоїдній тканині дихальних шляхів і кишечника. За своєю структурою вони дещо відрізняються від IgG. В IgE на один домен більше (СН4). Ця властивість обумовлює особливості біологічної функції IgE - здатність адсорбуватись на базофілах і тучних клітинах за допомогою цього додаткового домену Fc-фрагменту. Кількість IgE у здорових людей - 0,0002 г/л. Його рівень у сироватці підвищується при бронхіальній астмі, екземі, полінозах тощо.
Імуноглобуліни класу D. Будова імуноглобулінів цього класу подібна до IgG. Проте вони нездатні фіксувати комплемент. Більша кількість IgD перебуває в судинах, ніж за їх межами. У сироватці крові його кількість становить 0,01-0,02 г/л, проте у спинномозковій рідині концентрація сягає 5-7 мг/л при незначних кількостях імуноглобулінів інших класів.