
- •Методические указания по выполнению лабораторных работ
- •Инструкция по работе в химической лаборатории Общие правила работы в лаборатории
- •Обращение с реактивами
- •Меры предосторожности
- •Первая помощь при химических ожогах кожи
- •Первая помощь при ожогах глаз
- •Дополнительные меры по предупреждению пожаров, загораний и взрывов
- •Отчет по лабораторным работам
- •Лабораторная работа №1 Анализ этилового спирта
- •Лабораторная работа №2 Определение содержания органических кислот в спирте
- •Лабораторная работа №3 Определение воды в спирте
- •Лабораторная работа №4 Анализ этиленгликоля
- •Лабораторная работа №5 Анализ синтетических жирных кислот
- •Лабораторная работа №6 Определение содержания оксикислот
- •Лабораторная работа №7 Определение содержания неомыляемых веществ
- •Лабораторная работа №8 Определение содержание жирных кислот
- •Лабораторная работа №9 анализ нефтяных битумов
- •Определение растворимости
- •Методика определения
- •Лабораторная работа №10 Определение температуры размягчения
- •Устройство прибора
- •Определение пенетрации
- •Лабораторная работа №12 Определение растяжимости, или дуктильности
- •Литература
Лабораторная работа №2 Определение содержания органических кислот в спирте
Цель работы: Определение содержание кислот в спирте посредством титрования раствором едкой щелочи.
Содержание кислот в спирте определяется посредством титрования раствором едкой щелочи. Результаты анализа выражаются в расчете на уксусную кислоту (в мг на 1 л спирта).
Реактивы:
Едкий натр, 0,1н. раствор.
Лакмус, 1% водный раствор.
Методика определения
В две конические колбы емкостью 500 мл наливают по 100 мл испытуемого спирта, по 100 мл дистиллированной воды и по 0,5 мл раствора лакмуса.
Содержимое одной из колб при помешивании титруют 0,1 н. раствором NaOH до появления первого посинения раствора.
Для более отчетливого наблюдения за изменением окраски сравнивают цвета растворов в обеих колбах.
Количество кислоты в расчете на уксусную кислоту х (в мг на 1л спирта) подсчитывают по формуле.
х= V ∙ 0,006 ∙ 1000 ∙ 1000 /100 = 60 ∙ V
V – объем точно 0,1 н. раствора едкого натра, пошедший на титрование 100 мл спирта, мл;
0,006 – количество уксусной кислоты, эквивалентное 1 мл точно 0,1 н. раствора едкого натра, г.
Нейтрализованный раствор спирта сохраняет для определения в нем содержания сложных эфиров.
Вопросы:
1.Какие вещества называют спиртами?
2.Составьте уравнения реакций, характеризующие химические свойства спиртов.
3.Как на производстве получают этанол и метанол?
Лабораторная работа №3 Определение воды в спирте
Цель работы Определение воды в спирте.
Привзаимодействии воды, содержащейся в спирте, с карбидом кальция выделяется ацетилен:
CaC2 + H2O → C2H2 + Ca(OH)2
По объему выделившегося ацетилена подсчитывают эквивалентное количество воды.
Описание и подготовка прибора
Прибор для определения воды газометрическим методом представлен на рис.1. Один конец газовой бюретки 4 с реакционным сосудом 1, а к другому концу присоединена уравнительная склянка 5 с 10% раствором хлористого кальция, насыщенным ацителеном.
Перед началом определения вынимают пробку из реакционного сосуда, открывают кран и поднятием уравнительной склянки доводят жидкость в бюретке до нулевой отметки. Закрыв кран, уравнительную склянку устанавливают на стол. Если при этом уровень жидкости в бюретке сначала понизится, а затем установится на определенном месте, кран бюретки герметичен.
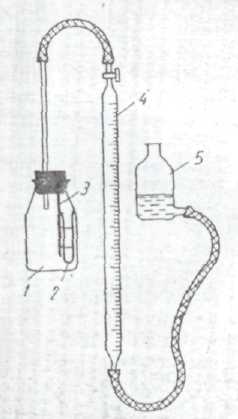
Рис. 1 Прибор для определения воды: 1- реакционный сосуд; 2- пробирка; 3- держатель пробирки; 4 – газовая бюретка; 5 – уравнительная склянка.
Из бюретки наливают в пробирку 0,5-1,0 мл анализируемого спирта с таким расчетом, чтобы при реакции выделилось не более 90 мл ацетилена. Пробирку с помощью резинки быстро прикрепляют к держателю – стеклянной палочке, вделанной в пробку. Затем этой пробкой закрывают реакционный сосуд, куда предварительно насыпают 1-2 г карбида кальция, и собранный прибор проверяют на герметичность.
Поднятием уравнительной склянки устанавливают жидкость в бюретке и в уравнительной склянке на одном уровне, который считают за начальное положение. Банку осторожно наклоняют и дают испытуемой жидкости по каплям вытекать на карбид кальция. Выделившийся ацетилен поступает в бюретку. Сосуд несколько раз встряхивают до прекращения изменения объема газа в бюретке. Измеряют объем ацетилена, отмечая при этом температуру окружающего воздуха и атмосферное давление.
Объем газа, собранного в бюретке, приводят к нормальным условиям.
Чтобы знать навеску испытуемого спирта, необходимо определить его плотность ареометром или пикнометром.
Содержание воды х (в вес. %) подсчитывается по формуле
х = V0 ∙ 0,001608 ∙ 100 / ρ ∙V1 = V0 ∙ 0,001608 / ρ ∙V1
где V0 – объем выделившегося ацетилена при нормальных условиях, мл;
0,001608 – количество воды, эквивалентное 1 мл ацетилена, г/мл;
V1 – объем испытуемого спирта, мл;
ρ – плотность испытуемого спирта, г/см3.
Вопросы:
1.Составьте электронные формулы метилового спирта, этилового спирта и воды. Поясните, как при перекрывании соответствующих электронных облаков образуются химические связи в молекуле воды и в гидроксильной группе спиртов.
2.Что такое водородная связь и как можно объяснить ее образование?
3. Как действуют метанол и этанол на живые организмы?
