
- •Методичні розробки
- •Частина 2
- •Ужгород – 2005
- •Передмова
- •Класифікація хімічних елементів
- •Електронні структури атомів
- •Електронегативність атомів неметалів
- •Явище алотропії
- •Будова простих речовин
- •Хімічні властивості простих речовин
- •Одержання неметалів
- •Огляд елементів
- •Водневі сполуки неметалів
- •Властивості оксидів неметалів
- •Одержання оксидів
- •Кислоти
- •Класифікація кислот
- •Фізичні властивості кислот
- •Номенклатура кислот
- •Хімічні властивості кислот
- •Одержання кислот
- •Використання кислот
- •Важливіші солі кислот
- •Лабораторна робота
- •Загальні властивості металів
- •Елементи-метали в періодичній системі
- •Металічний зв'язок
- •Кристалічна структура металів
- •Фізичні властивості металів
- •Хімічні властивості металів
- •2. Взаємодія з кислотами
- •Знаходження в природі
- •Загальні принципи промислового одержання металів
- •Термічний аналіз
- •Загальні властивості сполук металів
- •Оксиди металів
- •Гідроксиди металів
- •Загальна характеристика
- •Поширення у природі
- •Прості речовини
- •З активними металами р-метали при сплавленні утворюють бінарні сполуки постійного складу, в яких роль р-метал проявляє відповідний групі негативний ступінь окиснення:
- •Сполуки елементів
- •Гідроксиди
- •Якісні реакції на елементи
- •Використання
- •Твердість води та її усунення
- •Усунення постійної твердості води:
- •Лабораторні роботи:
- •Елементи і в підгрупи Властивості елементів та їх простих речовин:
- •Одержання:
- •Елементи іі в підгрупи Властивості елементів та їх простих речовин:
- •1. Взаємодія з неметалами
- •Одержання металів. Цинк та кадмій добувають відновленням їх оксидів вуглецем:
- •Елементи ііі b підгрупи
- •Елементи іv в підгрупи
- •Метали. Титан, цирконій та гафній – сріблясті тугоплавкі метали, на поверхні яких утворюється щільна оксидна плівка, яка захищає їх від окиснення.
- •Елементи V в підгрупи
- •Елементи VI в підгрупи Властивості елементів та простих речовин
- •Елементи viі в підгрупи Властивості елементів та простих речовин
- •Сполуки Mn(II).
- •Елементи VIII в підгрупи Властивості елементів підгрупи заліза
- •Гідроксиди металів(II) утворюються при дії розчинів лугів на солі металів(II) без доступу повітря:
- •Якісні реакції на іони:
- •При зневодненні кристалогідрату хлориду міді() із 2,046 г кристалогідрату одержано 1,614 г безводного хлориду міді(). Визначити число молекул води в кристалогідраті.
- •Література для самостійної роботи студентів
Використання кислот
HF
– для одержання
фторорганічних речовин, у виробництві
рідкісних металів
HCl – для одержання солей, для травлення металів в техніці, як реактив в хімічних лабораторіях, в органічному синтезі.
HBr – для одержання бромідів
H2SО4 – для одержання соляної, азотної, фосфорної, плавикової і багатьох органічних кислот методом обміну, для одержання фосфорних і азотних добрив, органічних сульфосполук, для очистки різних газів, входить в склад нітруючих сумішей, використовується в виробництві барвників і вибухових речовин, для зарядки акумуляторів і т.д.
Важливіші солі кислот
Хлориди
![]() Cln:
NaCl (кам’яна, або поварена сіль) – сировина
для одержання хлору, їдкого натру,
натрію, хлороводню, соди; KCl
– калійне добриво; CaCl2
– для осушування газів; BaCl2
– ядохімікат; ZnCl2
– для
протравки.
Cln:
NaCl (кам’яна, або поварена сіль) – сировина
для одержання хлору, їдкого натру,
натрію, хлороводню, соди; KCl
– калійне добриво; CaCl2
– для осушування газів; BaCl2
– ядохімікат; ZnCl2
– для
протравки.
Гіпохлорити (ClО)n утворюються разом з хлоридами при взаємодії хлору з розчинами лугів при кімнатній температурі: 2Ca(OH)2+2Cl2 CaCl2+Ca(ClO)2+2H2O
CaCl(OCl) або CaOCl2 (хлорне, або білильне вапно) – дуже сильний окисник (CaOCl2+CO2 CaCO3+Cl2) – відбілююча і дезинфікуюча речовина (2CaOCl2+H2O+CO2 CaCO3+CaCl2+2HClO)
Гіпохлорити та хлорити в вільному стані нестійкі, а у водному розчині є сильними окисниками.
Хлорати (ClО3)n утворюються при електролізі водних розчинів хлоридів, а також при розчиненні хлору в гарячому розчині лугу: 6КOH+3Cl2 5КCl+КСlO3+3H2O
КСlO3
(бертолетова
сіль) – сильний окисник (КСlO3+6HCl
3Cl2+KCl+3H2O),
використовується для одержання кисню
в лабораторії (2КСlO3![]() 2КСl+3O2),
для виробництва вибухових речовин, для
одержання перхлоратів (4КСlO3
3КСlO4+КСl).
2КСl+3O2),
для виробництва вибухових речовин, для
одержання перхлоратів (4КСlO3
3КСlO4+КСl).
Сульфіти 2(SО3)n при нагріванні розкладаються з утворенням сульфату та сульфіду: Na2SO3 3Na2SO4+Na2S
Сульфати 2(SО4)n найчастіше використовуються у вигляді кристалогідратів:
Na2SO410H2O (глауберова сіль) – для виробництва соди і в виробництві скла; СaSO42H2O (гіпс) – у будівництві; MgSO47H2O (гіпс) – в медицині; FeSO47H2O (залізний купорос) – для консервування дерева, виготовлення чорнила; СuSO45H2O (мідний купорос) – для боротьби з грибками, виробництва мідних покрить, одержання сполук купруму;
подвійні солі сульфатів одно- і тривалентного металу називаються галунами, їх використовують при виробці шкіри: KCr(SO4)212H2O (K2SO4 Cr2(SO4)324H2O).
Нітрати (NО3)n малостійкі при високій температурі, вони розкладаються по різним схемам в залежності від активності металу солі:
Ме розташований в ряду активності лівіше Mg (включно і Mg):
(NО3)n
![]() (NО2)n
+ O2
(NО2)n
+ O2
2NaNO3 2NaNO2 + O2
Сa(NO3)2 Сa(NO2)2+ O2
Ме розташований в ряду активності від Al до Cu включно:
(NО3)n On+NO2 + O2
2Cu(NO3)2 2CuO + 4NO2 + O2
4Al(NO3)2 2Al2O3 + 8NO2 + O2
Ме розташований в ряду активності правіше Cu: (NО3)n Me + NO2 + O2
2AgNO3 2Ag + 2NO2 + O2
Широко використовуються нітрати амонію, калію, натрію, кальцію (селітри) як азотні добрива та для виробництва вибухових речовин.
Фосфати 3(РО4)n, гідрофосфати 2(НРО4)n, дигідрофосфати (Н2РО4)n
Фосфорні добрива:
Фосфоритна мука: подрібнений фосфорит Са3(PO4)2
Простий суперфосфат: Са3(PO4)2+2H2SO4 2CaSO4+Ca(H2PO4)2
Подвійний суперфосфат: Са3(PO4)2+4Н3РО4 3Ca(H2PO4)2
Преципітат: Са(ОН)2+Н3РО4 CaHPO4H2O+H2O або СаСО3+Н3РО4 CaHPO4H2O+СO2
Амофоси: NH3+H3PO4 NH4H2PO4 та 2NH3+H3PO4 (NH4)2HPO4
Карбонати 2(CО3)n, гідрокарбонати (НCО3)n
властивості: розклад при прокалюванні: 2(CО3)n 2Оn+CO2 (окрім карбонатів лужних металів);
при взаємодії з сильними кислотами утворюється СО2: 2(CО3)n+2HCl Cl n+Н2О+СО2
Na2CO3 (cода), NaHCO3 (питна cода)
одержання в промисловості: 1) аміачний метод: NH3+CO2+H2O NH4HCO3
NH4HCO3+NaCl NaHCO3+NH4Cl
NaHCO3 Na2CO3+H2O+CO2
2) сульфатний метод: Na2SO4+2C Na2S+2CO2
Na2S+CaCO3 CaS+ Na2CO3
Вапняк (мармур, крейда) СаСО3
Силікати 2(SiО3)n
Na2SiO3, K2SiO3 – рідке скло
На основі силікатів відбувається виробництво скла, кераміки, цегли, цемент: кварцеве скло одержують переплавкою диоксиду кремнію; віконне чи пляшкове скло виготовляють, нагріваючи суміш піску, вапняку, соди: ; для виробництва фарфору, фаянсу та гончарних виробів викоритовують шихту з глини, кварца та польового шпату; для виготовлення цегли виготовляють шихту з глини і піску; цемент виготовляють відпалом суміші глини, вапняку і піску.
Борати – солі борних кислот
Бура Na2B4O7Н2О – сіль ізополікислоти складу 2В2О3Н2О
одержання: 2NaOH+4H3BO3 Na2B4O7+7Н2О
властивості: Na2B4O7+ H2SO4+5Н2О Na2SO4+4H3BO3
Na2B4O7+ CoO 2NaBO2Co(BO2)2 (склоподібні перли)
Тестові завдання:
Поділ елементів на метали і неметали, їх положення в періодичній таблиці.
Відмінність будови атомів неметалів від металів. Відмінність у їх фізичних і хімічних властивостях.
Характеристика оксидів неметалів.
Загальна характеристика елементів головної підгрупи УІІ групи.
Добування водню в лабораторії і промисловості.
Хімічні властивості водню.
Добування галогенів у лабораторії і промисловості.
Добування галогеноводнів і їх хімічні властивості.
Якісні реакції на Cl–, Br–, I–.
Поясніть причину різного проходження реакцій галогенідів натрію з концентрованою сірчаною кислотою.
Характеристика кисневмісних сполук хлору та їх солей.
Загальна характеристика елементів головної підгрупи УІ групи.
Виходячи з конфігурації зовнішньої електронної оболонки атомів елементів УІ групи головної підгрупи охарактеризуйте їх валентні можливості.
Лабораторні і промислові методи добування кисню.
Хімічні властивості кисню.
Добування сірки і її фізичні властивості.
Сірководень: добування, властивості.
Хімічні властивості сірки, її оксиди.
Добування та хімічні властивості сірчаної кислоти.
Закінчити рівняння реакцій:
H2S+SO2 SO2+H2O+Br2 SO2+KClO3+ H2O SO2+KClO4+ H2O SO2+KMnO4+H2SO4 H2SO4(конц.)+Cu H2SO4(конц.)+P H2SO4(конц.)+C H2SO4(конц.)+KBr H2SO4(конц.)+NaI H2SO4(конц.)+MnO2+ Na2SO3+KMnO4+ H2SO4 K2Cr2O7+NaNO2+ H2SO4
Загальна характеристика елементів головної підгрупи У групи.
Аміак, його добування і хімічні властивості.
Оксиди азоту, їх добування і властивості.
Оксиди фосфору, їх добування і властивості.
Добування азотної і фосфорної кислоти.
Особливості взаємодії азотної кислоти з металами.
Хімічні властивості фосфору.
Фосфорні добрива.
Закінчити рівняння хімічних реакцій
N2+H2 NH3+CuO NH3+NaClO NH3+O2
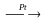 NH3+O2
NH3+HNO3
NH4NO2
NH3+O2
NH3+HNO3
NH4NO2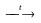 NH4NO3
P+
HNO3(лщрц.)
KNO2+H2SO4KNO3+
KNO2+K2Cr2O7+
HNO3
KNO3+Cr(NO3)3+
KI+KNO2+H2SO4I2+NO+
FeCl2+NaNO2+NaOHNaAlO2+
NO+SO2N2+
HNO3
HNO2
NO2+NaOH
Ca3(PO4)2+H3PO4
Ca3P2+H2O
NH4NO3
P+
HNO3(лщрц.)
KNO2+H2SO4KNO3+
KNO2+K2Cr2O7+
HNO3
KNO3+Cr(NO3)3+
KI+KNO2+H2SO4I2+NO+
FeCl2+NaNO2+NaOHNaAlO2+
NO+SO2N2+
HNO3
HNO2
NO2+NaOH
Ca3(PO4)2+H3PO4
Ca3P2+H2O
Загальна характеристика елементів підгрупи вуглецю.
Хімічні властивості С. Карбіди.
Оксиди вуглецю.
Вугільна кислота, карбонати та гідрокарбонати.
Добування та хімічні властивості SiO2. Кремнієва кислота.
Добування скла та цементу.
Закінчити рівняння хімічних реакцій
CaO+C CaCO3+SiO2 Na2CO3+SiO2 Na2SO4+C+CaCO3+SiO2 SiO2+HF SiO2+C SiO2+Al Ca(OH)2+CO2(надлишок) Si+NaOH+H2O C+H2SO4(крнц.) C+HNO3(конц.) C+CO2 CuO+C CO+NaOH CO+O2 CO+H2 CO+Cl2 Si+HF+HNO3
Природні сполуки бору і його добування.
Хімічні властивості бору.
Оксид бору та борна кислота.
