
- •Поняття вищої біології у школі.
- •3. Факультативи, індивідуальні факультативи. Поглиблене вивчення хімії.
- •4. Іонні рівняння.
- •2. Поурочне планування по темі:Птахи
- •3.Поглиблене вивчення хімії. Факультативні заняття. Види факультативів
- •1. Проблемне навчання хімії, його застосування при вивчення органічної хімії
- •2. Методика проведення порівняльної характеристики підгрупи лужних металів Пояснити, чому літій розпочинає електрохімічний ряд напруг.
- •1.Екологічне виховання.
- •2.Комбінований урок
- •Зміст і структура програми з хімії.
- •4.Окисно – відновні реакції
- •1. Масова робота учнів з біології в школі.
- •2.Біологічні диктанти. Складіть текст біологічного диктанту з теми :. Екосистем
- •4. Взаємодія металів з нітратною кислотою.
- •4. Методика вивчення особливостей взаємодії нітратної кислоти з металами. Написати рівняння можливих реакцій взаємодії міді з нітратною кислотою різної концентрації.
- •1. Нетрадиційні уроки
- •2. Організація самостійної роботи учнів з біології
- •3. Основні дидактичні принципи навчання хімії
- •4. Формування понять гомології та ізомерії в шкільному курсі органічної хімії. Методичний прийом складання формул ізомерів
- •2. Ізомери відрізняються будовою вуглецевого скелету молекул
- •1.Розкрийте особливості викладання біології в середніх загальноосвітніх закладах на сучасному етапі.
- •Навчально-методична робота вчителя. Шкільне планування.
- •4.Методика розв’язування задач на виведення молекулярної формули речовини за масовими частками елементів.
- •Самостійна робота зпідручником. Розробіть завдання для роботи з текстом підручника по вибраній вами темі.
- •Методика використання комп’ютерних технологій при вивченні шкільного курсу хімії.
- •1. Масова позакласна робота з біології в школі.
- •2. Тематичне оцінювання з біології
- •4. Електронна природа хімічних зв’язків в органічних сполуках, гібридизація.
- •Методичні особливості вивчення органічної хімії на прикладі одного класу сполук
- •3. Інтерактивні методи навчання у біології (теор)
- •4.Тематичне оцінювання з біології
- •1. Біологічний кабінет
- •3.Методи дослідження, що використовуються в мвх. Нові педагогічні технологі
- •1. Генетичний зв'язок між вуглеводами,спиртами і альдегідами
- •3. Урок узагальнення і систематизація знань.
- •4. Усна перевірка учнів з біології.
- •Позаурочна робота з біології як обов'язкова
- •2. Дидактичний матеріал з біології. Розробіть дидактичну картку для перевірки знань учнів по темі «Пластичний обмін», «Біосинтез білка».
- •3. Роль хімічної мови в процесі навчання хімії. Обсяг і зміст мовних знань та вмінь у шкільному курсі хімії. Систематична хімічна термінологія та номенклатура
- •4. Методика вивчення хімічних властивостей бензену
- •1.Галогенування
- •2.Нітрування
- •1. Організація території та дослідницької роботи учнів на шкільній ділянці.(29)
- •2. Обґрунтуйте важливість такого етапу уроку як актуалізація опорних знань та чуттєвого досвіду. Запропонуйте свій варіант проведення цього етапу уроку.(23)
- •4. Електронна природа хімічних зв’язків в органічних сполуках, гібридизація.
- •5. Методика вивчення хімічних властивостей бензену
- •1.Галогенування
- •2.Нітрування
- •Вивчення національних традицій та елементів народознавства на уроках біології.
- •Лабораторні та практичні роботи з біології, методика їх проведення на прикладі конкретної
- •Урок – основна форма організації навчання хімії. Вимоги до уроку з хімії. Типи уроків з хімії.
- •Урок засвоєння нових знань і набуття нових вмінь.
- •Структура комбінованого уроку. Запропонувати тему.
- •2. Трудове виховання.
- •3..Розвиток початкових хімічних понять у вивченні теми: « Оксиген. Кисень. Оксиди. Окиснення. Горіння». Системний підхід до вивчення теми.
- •4.Експериментальна перевірка знань. Як за допомогою одного реактиву можна визначити де є спирт, альдегід та глюкоза.
- •1.Екологічне виховання при вивченні біології в школі.(3)
- •2.Аналіз шкільного підручника для 7 класу.(3)
- •1. Аналіз тексту
- •2.Аналіз методичного апарату
- •3.Організаційні форми навчальної роботи з хімії (22)
- •4.Методика складання та розв»язування розрахункових задач за хім. Рівнянням (45)
- •Зміст і структура біологічної освіти у школі.
- •2. Роль наочності при викладанні в школі. Порівняльна характеристика прокаріот та еукаріот.
- •3.Методи контролю знань.
- •Сутність, функції, види контролю при викладанні біології.
- •Характеристика підручника з біології за 8 клас.
- •Словесно-навчальні методи
- •Формування системи понять про хімічні реакції. Класифікація хімічних реакцій
- •Методи письмового контролю
- •2. Нестандартний урок
- •3. Предмет і завдання методики викладання хімії
- •4. Формулювання поняття про валентність елементів. Алгоритм визначення валентності елементів за формулою
- •1.Методи навчання та їх класифікація.(10)
- •2. Навчально – виховні завдання вивчення біології в школі. Сформулюйте завдання уроку вибраної вами теми (1)
- •4. Зв’язок методики викладання хімії з методологією хімічної науки, педагогікою, психологією та іншими науками.
- •1. Екскурсії з біології. Їх значення та методика проведення.
- •3. Матеріальна база навчання біології
- •4. Прості і складні речовини.
- •Предмет,методи і завдання мвб.
- •Практичні і лабораторні роботи.
- •Карбонатна кислота.
- •Визначте масову частку Na і Na2o.
- •Моль. Стала Авогадро. Маса та об’єм аміаку.
- •3. Державні нормативні документи, що відображають зміст хімічної осівти.
- •4.Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою електронних оболонок атомів (р, n)
- •1. Поняття та їх роль у формуванні біологічних знань. Загальнобіологічні та спеціальнобіологічні поняття. Формування і розвиток біологічних понять при виченні біології.
- •2.Досліди на уроках біології. Методика їх демонстрування. Запропонуйте методичну розробку доліду по вибраній темі з біології.
- •3.Загальнологічні методи пізнання хімії. Використання прийомів логіки при вивченн інеорганічної хімії.
- •4.Особливості вивчення механізму електролітичної дисоціації йоних, ковалентних, полярних сполук
- •1. Екскурсії, їх значення, та методика викладання
- •1. Аналіз шкільного підручника для 10 кл.
- •2. Методи навчання хімії, що застосовуються у процесі удосконалення знань
- •1.Навчально – наочні посібники з біології та їх використання на уроках.(13)
- •2.Формування пізнавального інтересу учнів до біології на прикладі конкретної теми
- •4.Процес навчання хімії, його основні компоненти і засоби
- •2. Методи організації та здійснення навчально-пізнавальної діяльності.
- •4. Періодичний закон д. І. Менделєєва
- •1.Навчально – наочні посібники з біології та їх використання на уроках.(13)
- •2.Формування пізнавального інтересу учнів до біології на прикладі конкретної теми
- •4.Процес навчання хімії, його основні компоненти і засоби
4. Електронна природа хімічних зв’язків в органічних сполуках, гібридизація.
Типи хімічних зв’язків: іонні, ковалентні, водневі, металічні і вандервальсівські.
Хімічний зв'язок між атомами утворюється при перекриванні атомних орбіталей двох електронів. Пара електронів, яка утворює зв'язок, локалізується між двома атомами, учасниками зв’язку. Кожний зв'язок утворюється парою електронів з антипаралельними спінами. Гібридиза́ція орбіта́лей — суперпозиція різних, але близьких за енергією орбіталей даного атома, з виникненням того ж числа нових гібридних орбіталей, однакових за енергією. Гібридизація атомних орбіталей відбувається при виникненні ковалентних зв'язків між атомами. При гібридизації s- і p-орбіталей, розрізняють такі основні типи:sp3-гібридизація відбувається при змішуванні однієї s- і трьох p-орбіталей. Виникає чотири однакові орбіталі, розташовані одна щодо іншої під кутами тетраедрів 109°28’. Прикладом sp³-гібридизацї є молекула метану, або кристалічна ґратка типу алмазу (кремній, германій, арсенід галію).sp2-гібридизація відбувається при змішуванні однієї s- і двох p-орбіталей. Утворюється три гібридні орбіталі з осями, розташованими в одній площині і направленими до вершин трикутника під кутом 120 градусів. Негібридна p-атомна орбіталь перпендикулярна площині і, як правило, бере участь в утворенні π-зв'язків. Прикладом sp²-гібридизації є молекула бензолу, ненасичені полімери, графіт.
sp-гібридизація відбувається при змішуванні однієї s- і однієї p-орбіталей. Утворюється дві рівноцінні sp-атомні орбіталі, розташовані лінійно під кутом 180 градусів і направлені в різні боки від ядра атома. Дві решту негібридні p-орбіталі розташовуються у взаємно перпендикулярних площинах. sp-гібридизація утворюється в насичених полімерах.

Рис. 2. Форма и расположение электронных облаков при sp3-(a) и sр2-гибридизациях (б).
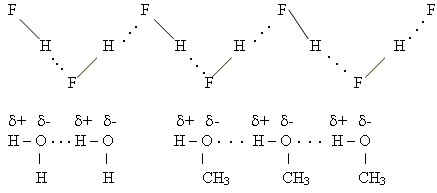
Водневий зв'язок утвор між атомами гідрогену й атомами електронегативних елементів різних молекул однієї і тієї самої речовини, які мають неподілені пари електронів.
Якщо під час сполучення двох атомів утворюються спільні пари електронів, що обертаються у полі ядер обох атомів, то такий зв'язок назив-ковалентним.
Зв’язок, що виникає між двома однаковими атомами, коли електронна пара розміщується симетрично центрів обох атомів, називають ковалентним неполярним зв’язком.
Він виникає між атомами неметалів одного виду, оскільки в них однакова електронегативність. Між двома атомами може утворюватися різне число ковалентних зв’язків:
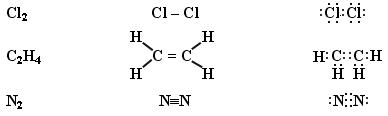
Це не стосується молекули кисню О2, будову якої важко пояснити методом молекулярних зв’язків. Треба застосовувати метод молекулярних орбіта лей.
Зв’язок, що виникає між атомами з різною електронегативністю, називають ковалентним полярним зв’язком
Якщо атоми хімічних елементів відрізняються своєю електронегативністю, то відбувається зміщення електронної пари до атомів більш електронегативного елемента і поляризація молекул, виникає диполь:
![]()
Але не завжди ковалентний полярний зв’язок зумовлює утворення диполя:
![]()
Залежно від способу перекривання орбіталей розрізняють б (сигма) – зв’язки і π (пі) – зв’язки.
б – зв’язки виникають унаслідок перекривання орбіталей вздовж прямої, що сполучає ядра атомів, які взаємодіють. Він утворюється за рахунок однієї електронної пари, тому завжди простий (ординарний):
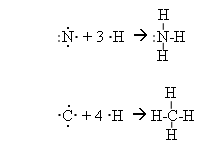
π -зв’язок виникає унаслідок перекривання р – орбіталей з обох боків від лінії, що проходить через центри атомів, які взаємодіють, тобто перпендикулярно до осі б - зв’язку:
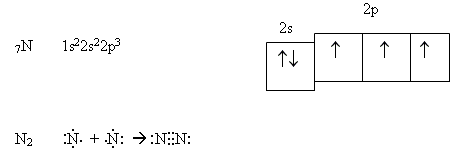
Рис. 1.3.3. Схема перекривання 3 р -орбіталей у молекулі азоту N2
а - бзв'язок; б, в - π -зв'язки
Окрім механізму спарювання електронів, є ще донорно-акцепторний механізм утворення ковалентного зв’язку. За рахунок неподіленої електронної пари одного атома (донора) і вільної орбіталі іншого атома (акцептора) виникає ковалентний зв’язок:
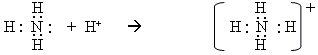
При цьому всі
чотири зв’язки N
– H в йоні
амонію
![]() рівноцінні
у всіх відношеннях – за довжиною,
енергією тощо. Вони лише утворилися
різними шляхами.
рівноцінні
у всіх відношеннях – за довжиною,
енергією тощо. Вони лише утворилися
різними шляхами.
Йонний зв’язок – це хімічний зв’язок, що зумовлений електростатичним притяганням різнойменно заряджених йонів, на які перетворюються атоми внаслідок віддавання і приєднання електронів
Електричний заряд, якого при цьому набувають йони, називається зарядом іонів:
![]()
Йонний зв’язок утворюється між атомами елементів, які значно відрізняються за своєю електронегативністю.
Металічний зв’язок – це хімічний зв’язок, зумовлений взаємодією делокалізованих валентних електронів (електронного газу) з позитивно зарядженими йонами кристалічних граток металів. У атомах металічних елементів число валентних електронів набагато менше, ніж вільних орбіталей, внаслідок чого можливе вільне переміщення електронів по орбіталях різних атомів одного й того самого металу. Електрони усуспільнюються всіма атомами металу. Такий вид зв’язку характерний для металів у твердому і рідкому станах, а в газуватому атоми в металах зв’язуються між собою тільки ковалентними зв’язком (Li2, Cu2 та ін.
