
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Термодинамический анализ
Цель: теоретическое обоснование возможности практической реализации выбранного способа производства, а также получение данных по предельной эффективности данного химического процесса.
-
Изобарно-изотермический потенциал (энергия Гиббса)
Направленность (самопроизвольность протекания) химических реакций определяют по значениям термодинамических потенциалов.
Наиболее подходящим потенциалом (характеристической функцией) для химических реакций, протекающих, как правило, в изотермических условиях (T=const) при постоянном давлении (p=const), является изобарно-изотермический потенциал – энергия Гиббса (ΔG). Она включает в себя два слагаемых:
-
первое - ΔН связано с тепловым эффектом реакции;
-
второе - ТΔS связано с изменением энтропии процесса;

Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
Изменение стандартной энергии Гиббса в процессе химической реакции равно алгебраической сумме произведений стехиометрических коэффициентов всех участников реакции на их значения ΔG0 образования с учетом знаков. Для реагентов стехиометрические коэффициенты - отрицательны, для продуктов реакции – положительны.
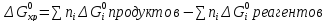
Соответственно для каждого вещества его стандартная энергия Гиббса может быть вычислена как сумма стандартного изменения энтальпии образования его из простых веществ и энтропии при 298 К с учетом температурного множителя:

Обычно по справочным данным рассчитывают изменения ΔH0 и ΔS0 реакции по формуле, аналогичной формуле энергии Гиббса:

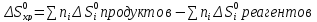
Если:
-
ΔG > 0, реакция термодинамически запрещена;
-
ΔG < 0, не имеет термодинамических ограничений;
Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала (энергия Гиббса) реакции уравнением Вант-Гоффа:
ΔG° = ΔН° – ТΔS° = – RT lnK
Связь
константы равновесия реакции и температуры
(изобара Вант-Гоффа):

Это уравнение позволяет проводить термодинамический анализ реакционных систем при известных или рассчитанных по справочным данным изменениях энтальпии (ΔН°) и энтропии (ΔS°) реакции.
В соответствии с законом действия масс константа равновесия устанавливает связь между концентрациями исходных веществ и продуктов реакции, и, следовательно, определяет достижимый в данных условиях максимально возможный выход продукта.
Для реакции: аА + вВ = rR + sS
константа равновесия может быть выражена через молярные концентрации веществ – концентрационная константа (Кс):

Для газофазных реакций константу равновесия выражают через парциальные давления реагентов:

Для идеальных газов Кс и Кр связаны соотношением

Где
 изменение количества молей
изменение количества молей
В первом приближении можно считать, что константа равновесия не зависит от давления и является функцией только температуры. Это справедливо при низких давлениях и высоких температурах. При высоких давлениях законы для идеальных газов перестают описывать наблюдаемые зависимости. Были введены понятия летучести, активности и коэффициента активности. Взаимосвязь летучести и давления выражается уравнением:

где fi – летучесть i-компонента (параметр вещества, характеризующий его способность переходить из жидкого состояния в газообразное) , Pi – парциальное давление i-компонента, γi – безразмерный коэффициент активности (индивидуален и зависит от природы газа и вещества), зависящий от давления и температуры.
Фугитивность – это такое давление реального газа, при котором газ ведет себя как идеальный.
При f→P свойства реальных газов приближаются к свойствам идеальных газов, а коэффициент фугитивности стремится к единице γ→1.
Активностью
данного вещества называют отношение
его летучести к той же величине, в
стандартном состоянии:
 .
За стандартное
состояние газа
принято его состояние при любой
температуре с
летучестью, равной одной атмосфере.
Из этого следует, что летучесть газа
совпадает с его активностью.
.
За стандартное
состояние газа
принято его состояние при любой
температуре с
летучестью, равной одной атмосфере.
Из этого следует, что летучесть газа
совпадает с его активностью.
Выражение
для константы равновесия с использованием
равновесных летучестей (активностей)
и коэффициентов активности выглядит
следующим образом:
 ,
где Кf
– истинная (термодинамическая) константа
равновесия.
,
где Кf
– истинная (термодинамическая) константа
равновесия.
Истинная термодинамическая константа равновесия Кf или Ка не зависит от концентрации компонентов в системе.
Определяемые экспериментально через анализ концентраций кажущиеся (наблюдаемые) константы равновесия Кс и, соответственно, Кр зависят от концентраций реагирующих веществ или парциальных давлений и общего давления.
Константы равновесия также могут быть выражены, например, через отношения мольных долей Ni участников реакции (KN).
Для реакций, протекающих при небольших давлениях без изменения объема: Ка = Кр =Кf = КN.
Термодинамическая константа равновесия является функцией только температуры.
С другой стороны, кажущаяся константа равновесия (Кр) при высоких давлениях зависит от давления, поскольку меняется Кγ.
Для определения конечного состава системы используют кажущуюся константу равновесия; из расчёта на основе термодинамических параметров (изменение энтропии и энтальпии реакции) мы знаем истинную величину константы равновесия Кf или Ka в зависимости от фазового состояния веществ и температуры.
