
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Создание агрегатов большой единичной мощности
Создание агрегатов большой единичной мощности – одно из важнейших направлений, обеспечивающих снижение капитальных вложений, эксплуатационных затрат, себестоимости продукции и обеспечение высокой степени автоматизации.
Один большой реактор, в котором непрерывно, в стационарном режиме производится большое количество продукции, более экономичен, чем, например десяток меньших, вследствие снижения, в первую очередь, доли условно-постоянных затрат.
И большой, и маленький агрегат обслуживается соизмеримым количеством работников, одинаковы затраты на содержание административного аппарата и т.п., поэтому себестоимость продукции, получаемой в агрегатах большой единичной мощности, оказывается существенно ниже.
Дополнительный выигрыш получается также в результате концентрирования энергии. Доля потерь тепла в окружающую среду для большого агрегата существенно меньше, чем для маленького, энергия меньше рассеивается и может быть более эффективно использована.
Продукция агрегата, который производит 500 тыс. тонн продукта в год, должна непрерывно отгружаться потребителю или производитель должен располагать огромными хранилищами, что не всегда реализуется в условиях меняющейся конъюктуры.
Внеплановые остановки подобных агрегатов могут привести к большим затратам средств, а залповые выбросы при продувке систем приводят к сильному отрицательному воздействию на окружающую среду. Поэтому требуется высокая степень надёжности этих агрегатов. Помимо этого, существуют определенные технические сложности производства и монтажа гигантского оборудования.
Таким образом, увеличение размеров агрегатов целесообразно до определенных пределов.
-
Интенсификация хтп
Интенсификация ХТП может реализоваться за счет использования нетрадиционных методов технологии.
-
Плазмохимические методы.
В плазме в ионизированном газе при температуре примерно 2000С могут протекать очень важные реакции, например, прямой синтез оксида азота (II):
N2 + O2 = 2NO
Процесс сильно эндотермический и термодинамика запрещает этот процесс при температурах до 2000С. Применение плазмохимических методов при более высоких температурах сдерживается чрезвычайной энергоемкостью эти процессов.
-
Механохимия – механическое воздействие на реагенты при протекании химической реакции. Если реагенты предварительно подвергнуть обработке в шаровой мельнице, то увеличивается скорость протекающей между ними реакции.
-
Сонохимия – применение ультразвука для интенсификации химических реакций.
-
Процессы с использованием УФ-облучения. Облучение ультрафиолетом или даже видимым светом часто приводит к инициированию процесса, получению активных частиц, например, радикалов, которые являются носителями активности. С использованием ультрафиолета процессы можно проводить при более низких температурах по сравнению с термическим инициированием.
Раздел 2. Разработка химической концепции метода.
-
Классификация химико-технологических процессов (ХТП). Критерии эффективности химического превращения: выход, степень превращения сырья (конверсия), селективность, производительность и интенсивность работы аппарата, расходные коэффициенты по сырью. Технологические параметры ХТП: время пребывания (контактирования), объемная скорость.
Химико-технологический процесс (ХТП) – это совокупность физических и химических процессов, направленных на превращение исходных реагентов (сырья) в необходимые для дальнейшей переработки или потребления (целевые) продукты. Под обозначением «ХТП» подразумевают реакционную систему.
Основными признаками химического превращения являются:
а) химизм, включающий информацию о степени сложности протекающих реакций, их количестве и стехиометрии;
б) особенности термодинамики;
в) кинетические закономерности протекания ХТП;
г) фазовая характеристика системы, в которой протекает ХТП, и локализации самого ХТП.
Классификация.
-
С точки зрения химизма ХТП делят на простые и сложные:
-
Простой ХТП можно описать одним стехиометрическим уравнением превращения исходных реагентов, например, А и В в продукты Р и R:
-
аА + вВ = rR + pP, где а, в, r и p – стехиометрические коэффициенты.
При этом не все продукты основной реакции могут представлять одинаковую практическую ценность, поэтому их делят на целевые и побочные.
-
Сложный ХТП описывают более чем одним стехиометрическим уравнением, т.е. кроме основной реакции протекают параллельные, последовательные и параллельно-последовательные. Сложный ХТП всегда включает основную реакцию, дающую целевые продукты (иногда вместе с побочными) и побочные реакции, приводящие к образованию побочных продуктов.
С практической точки зрения различать простые и сложные процессы важно, поскольку для простого процесса выбор условий его проведения определяется только требованиями быстрого и полного протекания основной реакции. Для сложного процесса нужно при выборе условий в первую очередь обеспечить подавление побочных реакций при максимально возможных показателях основной реакции.
-
С термодинамической точки зрения ХТП делят на:
-
Необратимыми (односторонними) ХТП называют процессы, равновесие основной реакции которых практически полностью смещено в сторону образования продуктов во всем доступном для ХТП диапазоне изменения температуры и давления. Константа равновесия необратимого процесса остается больше, чем 102 во всем доступном диапазоне условий. Необратимыми можно считать и процессы, равновесие которых во всём диапазоне доступных для ХТП условий практически полностью смещено в сторону исходных реагентов. Такие процессы называют запрещенными по термодинамическим соображениям.
-
Обратимый (двухсторонний) ХТП – это процесс, на положение равновесия которого можно в заметной степени повлиять изменением условий проведения. Если в результате удается подобрать условия проведения ХТП таким образом, чтобы константа равновесия имела величину ~102 или больше, а равновесный выход целевого продукта был близок к 100% или к 1 (в долях), то процесс называют обратимым смещенным. Если константа равновесия и равновесный выход не достигают указанных значений в выбранных условиях проведения, то ХТП считают обратимым несмещенным.
-
-
Классификация ХТП по тепловому эффекту:
-
Если сумма тепловых эффектов положительна, т.е. преобладают реакции, протекающие с выделением тепла, то ХТП является экзотермическим (Q>0, ΔН<0). Для экзотермических ХТП необходимо обеспечить теплоотвод при соблюдении оптимального температурного режима в реакционной зоне (или организовать автотермический режим)
-
Если основной вклад в суммарный тепловой эффект вносят реакции, протекающие с поглощением тепла, то ХТП – эндотермический (Q<0, ΔН>0).
-
Изотермические. Проводят при постоянной температуре, отводя тепло экзотермических реакций и подводя тепло в случае эндотермических процессов. В случае экзотермических процессов тепло расходуется на поддержание оптимальной температуры. Такие реактор и процесс называют также адиабатическими.
-
В автотермических процессах рационально используется тепло, выделяющееся при протекании реакций, и существенно упрощается устройство реактора.
-
Рассмотрим основные показатели на примере реакции, которую будем считать основной реакцией ХТП.
aA + bB = pP
-
Степень превращения (степень конверсии) реагента (Х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
Количества реагента могут быть выражены в единицах массы, молях, в мольных потоках и, даже, в единицах объема, взятых при одинаковых условиях (температуре и давлении).

Где G - массы введенного и непрореагировавшего реагента А, соответственно; N – те же величины, выраженные в молях.
Если объем реакционной системы остается постоянным в ходе ХТП, то во всех расчетах количества веществ могут быть заменены их молярными концентрациями. При использовании формул степень превращения получают в долях единицы.
-
Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
Обе формулировки выражаются одной формулой. Для уравнения выходы продукта Р на реагенты А и В выражаются формулами:


где N - количества молей, соответственно, а, b и p – стехиометрические коэффициенты реакции.
Для уточнения связи формулы с двумя формулировками определения выхода перепишем ее для реагента А в двух видах: для первой формулировки и для второй.


Выражение (𝑵𝑷
∙
 )
в формуле – это количество
молей реагента А,
из которого образуется
NP
молей продукта Р
в соответствии с уравнением и т.д.
)
в формуле – это количество
молей реагента А,
из которого образуется
NP
молей продукта Р
в соответствии с уравнением и т.д.
Чаще выход рассчитывают для наиболее ценного (целевого) продукта на наиболее дорогой из реагентов.
-
Селективность – важнейший показатель сложного ХТП, характеризующий эффективность превращения сырья в целевой продукт.
Селективность образования продукта по реагенту (φ) – это отношение количества этого реагента, превратившегося в продукт, к общему количеству превратившегося реагента.
Для реакции (aA + bB = pP) селективность образования продукта Р по реагентам А и В выразится формулами, в знаменателе которых количество превращенного реагента. Символом N обозначены мольные количества веществ или мольные потоки (для открытых систем, работающих в стационарном режиме).


Для селективности есть второе определение: селективность – это отношение количества полученного практически продукта, к количеству этого продукта, которое должно было быть получено теоретически.
Если продукт образуется по нескольким реакциям, то селективность, как правило, рассчитать нельзя.
Дифференциальной
селективностью ( называют отношение
скорости расходования реагента
А
на образование продукта Р к суммарной
скорости превращения А. Рассчитывают
дифференциальную селективность как
отношение
скоростей образования продукта и
расходования реагента,
умноженное на обратное отношение
стехиометрических коэффициентов. Член
(
называют отношение
скорости расходования реагента
А
на образование продукта Р к суммарной
скорости превращения А. Рассчитывают
дифференциальную селективность как
отношение
скоростей образования продукта и
расходования реагента,
умноженное на обратное отношение
стехиометрических коэффициентов. Член
( )
в уравнении равен скорости
расходования А
на образование Р.
)
в уравнении равен скорости
расходования А
на образование Р.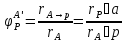
Взаимосвязь степени превращения реагента, выхода и интегральной селективности образования продукта.

Очевидно, что для простых ХТП селективность равна единице (100%) для всех продуктов единственной реакции (стехиометрического уравнения). В этом случае выход каждого из продуктов реакции по любому из реагентов равен степени превращения этого реагента (𝜼𝑨 = 𝑿𝑨).
В случае сложных ХТП для получения высокого выхода необходимо иметь высокие значения и степени превращения, и селективности. Если процесс протекает с полным превращением реагента, то выход продуктов по этому реагенту равен селективности образования каждого из продуктов по данному реагенту.
Критерии эффективности химического превращения
-
Производительность аппарата — это масса (или объем) выработанного целевого продукта за единицу времени:
![]()
где G – масса (или объем) продукта, полученная за время t.
-
Интенсивность работы аппарата.
Интенсивностью работы аппарата (I) называют его производительность, отнесенную к какой-либо величине, характеризующей размеры данного аппарата. Обычно производительность относят к объему аппарата V или к площади его сечения S:

В каталитических процессах рассчитывают интенсивность работы катализатора, для чего массу полученного за единицу времени целевого продукта относят к объему катализатора Vk:

-
Расходные коэффициенты по сырью. В связи с большим вкладом затрат на реагенты (сырье) в себестоимость продуктов в химической технологии особое значение имеют расходные коэффициенты по реагентам.
Различают теоретические и практические расходные коэффициенты.
Теоретический расходный коэффициент характеризует минимально возможный расход сырья на получение единицы массы продукта.

Практический расходный коэффициент отражает реальный расход поступившего в процесс сырья на получение единицы массы продукта, т.е. его рассчитывают, как отношение массы поступившего в процесс сырья к массе получившегося продукта:

Расходные коэффициенты рассчитывают по всем реагентам. Практические расходные коэффициенты всегда больше стехиометрических из-за неполноты превращения сырья, а также из-за расходования сырья на побочные реакции.
Практический расходный коэффициент по реагенту можно найти, зная теоретический расходный коэффициент и выход целевого продукта по этому реагенту:

Технологические параметры ХТП:
