
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Зависимость дифференциальной селективности от температуры
Для стехиометрически сложных реакций температура может по-разному влиять на скорости основной и побочных реакций и, тем самым, на дифференциальную селективность процесса.
Анализ формулы для дифференциальной селективности проведем при допущении, что n1 = n2.
Подставляя в уравнение выражения для k1 и k2 согласно уравнению Аррениуса, получаем:

С учетом допущения,
что отношение величин
 не
зависит от температуры и равно А0,
получаем:
не
зависит от температуры и равно А0,
получаем:

Если энергия активации основной реакции больше, чем энергия активации побочной реакции, то с ростом температуры дифференциальная селективность возрастает.
Если энергия активации основной реакции меньше, чем энергия активации побочной реакции, то с ростом температуры знаменатель увеличивается, и дифференциальная селективность падает.
-
Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
Формально уравнение данного процесса можно записать в виде:
2NO + O2 = 2NO2, ΔН = –124 кДж
Один из вероятных механизмов реакции связан с образованием промежуточного соединения - димера оксида азота (II):
2NO ↔ (NO)2, ΔH < 0
где ↔ знак обратимости реакции.
Равновесие в данной реакции устанавливается достаточно быстро, а последующая стадия протекает необратимо:
(NO)2 + О2 → 2NO2, ΔН < 0
Скорость образования NO2 в данной элементарной реакции согласно закону действия масс:

В то же время, выражения для константы равновесия имеет вид:

Откуда:

Подставив выражение в уравнение, получаем уравнение скорости реакции образования NO2:

Проанализируем полученную зависимость. Повышение температуры влияет как на константу скорости реакции (k) – она растет, так и на константу равновесия (Кр) – она падает (реакция – экзотермическая).
Суммарный эффект влияния температуры на наблюдаемую скорость реакции будет определяться их соотношением. При увеличении температуры, константа скорости реакции для данного случая растет медленнее, чем падает константа равновесия. Таким образом, будет иметь место уменьшение скорости окисления оксида азота (II) в оксид азота (IV) при повышении температуры/

-
Скорость обратимых реакций
Если для необратимых реакций скорость растет с ростом температуры (при Еакт. > 0), независимо от теплового эффекта реакции в соответствии с уравнением Аррениуса, то для обратимых реакций зависимость более сложная, поскольку скорости прямой и обратной реакции по-разному зависят от температуры, так как их константы скорости характеризуются разными энергиями активации.
-
Обратимая эндотермическая реакция
Для обратимой эндотермической реакции характерно превышение величины энергии активации прямой реакции над энергией активации обратной реакции. С ростом температуры в большей степени будет возрастать константа скорости прямой реакции, т.к. ее энергия активации больше энергии активации обратной реакции.
Поэтому для обратимых эндотермических процессов оптимальная температура равна максимально допустимой (как и для необратимых простых реакций), и ограничена максимальной селективностью, устойчивостью конструкционных материалов или экономическими соображениями. Для сложных процессов верхний температурный предел часто обусловлен возможностью протекания побочных реакций.
Необходимо подчеркнуть, что в случае обратимой эндотермической реакции с ростом температуры помимо увеличения скорости превращения реагента, имеет место и рост константы равновесия реакции, т.е. по принципу Ле-Шателье равновесие смещается вправо, равновесный выход увеличивается. Таким образом, повышение температуры влияет благотворно как на скорость процесса, так и на увеличение равновесного выхода продукта реакции.
-
Для обратимой экзотермической реакции термодинамический и кинетический факторы вступают в противоречие. При повышении температуры по принципу Ле-Шателье равновесие реакции смещается влево, равновесная степень превращения реагента падает и, соответственно, уменьшается выход продукта. Это следствие того, что с увеличением температуры возрастают скорости как прямой, так и обратной реакции, но возрастают по разному, так как характеризуются разными значениями энергии активации (Еакт.обр. > Еакт.прям).
Для простейшего
случая: А ↔ В, порядки прямой и обратной
реакции равны 1, k1
- константа скорости прямой, а k2
- константа скорости обратной реакции.
Скорость реакции по веществу В будет
складываться из скорости его образования
из реагента А и скорости его превращения
в реагент А, то есть:
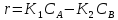
Так как с ростом температуры в большей степени будет возрастать константа скорости обратной реакции (k2), имеющей большую энергию активации, чем константа скорости прямой реакции (k1), то график зависимости скорости образования вещества В от температуры будет представлять собой кривую с максимумом.

С увеличением степени превращения реагента максимум на кривых зависимости скорости реакции от температуры будет смещаться в область более низких температур с уменьшением скорости реакции по мере приближения системы к состоянию равновесия.
Еще раз подчеркнем, что, в отличие от обратимых эндотермических процессов, при выборе оптимальных условий (по температуре) проведения обратимой экзотермической реакции имеется противоречие следующего рода. С позиции получения наибольшего равновесного выхода необходима низкая температура, а с позиции обеспечения максимальной скорости процесса чаще всего необходима высокая температура. И одним из способов разрешения такого противоречия является проведение процесса по ЛОТ. Другим приемом, используемым для разрешения этого противоречия, является работа при низкой степени превращения реагентов и организация рециклов.
В настоящем пособии укажем, что катализатор селективно понижает энергию активации основной реакции (ускоряет ее) и в случае сложных процессов значительно увеличивает селективность.

-
Кинетика гетерогенных процессов. Система «газ - твердое тело». Кинетические модели для описания гетерогенных процессов: квазигомогенная модель и модель с фронтальным перемещением зоны реакции (модель с непрореагировавшим ядром). Стадии гетерогенного процесса. Эффективная константа скорости гетерогенного химического процесса. Лимитирующая стадия процесса, ее признаки и способы определения. Интенсификация гетерогенных процессов.
Существует ряд кинетических моделей, несколько упрощающих природу гетерогенных процессов, но позволяющих описать их с помощью сравнительно простых уравнений. Наиболее распространенными среди них являются модель с фронтальным перемещением зоны реакции (модель с непрореагировавшим ядром) и квазигомогенная модель.
Рассмотрим, в чем отличие этих моделей на примере гетерогенной реакции, при протекании которой внешние размеры твердой частицы не меняются.

Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объема твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, т. е. если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.

Модель с фронтальным перемещением зоны реакции. Химическая реакция сначала протекает на внешней поверхности частицы, и до тех пор, пока внешний слой твердого реагента полностью не превратится в соответствующие твердые или газообразные продукты реакции, более глубинные слои в реакцию не вступают. Постепенно зона химической реакции продвигается внутрь, оставляя за собой твердый продукт реакции и инертную часть исходного твердого реагента (золу). В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагировавшего реагента. Окружающая его оболочка состоит из твердого продукта и инертных веществ.
Рассмотрим более детально особенности гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции. Объектом рассмотрения будет одиночная твердая частица с неизменяющимися во времени внешними размерами, обтекаемая потоком газообразного реагента А Об отдельных этапах процесса будем судить по концентрации реагента А в разных точках пространства.

Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно разделить на пять основных стадий:
1) диффузия газообразных (или жидких) реагентов из потока через пограничный газовый (или жидкий) слой к внешней поверхности частицы (внешняя диффузия);
2) внутренняя диффузия газообразных (или жидких) реагентов в порах твердого вещества к ядру твердого реагент;
3) химическая реакция на поверхности ядра;
4) внутренняя диффузия газообразных (или жидких) продуктов реакции в обратном направлении;
5) внешняя диффузия газообразных (или жидких) продуктов через пограничный слой в поток.
В качестве примера рассмотрим некий гетерогенно-каталитический процесс с участием газообразного реагента. Выражения для скоростей внешней (через пограничный газовый слой толщиной δ у поверхности катализатора) и внутренней (в порах к внутренней поверхности катализатора) диффузии запишем по закону Фика уравнениями.
Внешняя диффузия:

Внутренняя диффузия:

Примем, что скорость
химического превращения на поверхности
катализатора пропорциональна концентрации
реагента:

где CU, CF, CS - концентрации газообразного реагента в объеме потока, у внешней поверхности и у внутренней поверхности катализатора, соответственно. β - коэффициент массоотдачи D -коэффициент диффузии, δ - толщина ламинарной газового слоя вокруг твёрдой частицы;
k - константа скорости химической реакции; β ' - коэффициент массоотдачи в твердой фазе, Dэф - эффективный коэффициент диффузии, Rэ – радиус зерна катализатора.
Поскольку концентрации у внешней и внутренней поверхности катализатора трудно измерить и они, как правило, не известны, выразим скорость реакции в стационарном режиме (скорости всех последовательных стадий, перечисленных выше, равны между собой) через известную концентрацию реагента в объеме. Приравняв скорости внешней, внутренней диффузии и химической реакции (r = rU = rF) и проведя простые преобразования для исключения неизвестных концентраций CF и CS, получим.







где r - скорость гетерогенного процесса; kнабл - эффективная константа скорости гетерогенного процесса; 1/k, 1/β, 1/β ' - сопротивления химической реакции, внешней и внутренней диффузии, соответственно.
Лимитирующую стадию можно экспериментально определить, изучая зависимость скорости гетерогенного процесса от температуры Т, линейной скорости газового потока u и степени измельчения 1/ R.

Если сопротивление на одной из стадий значительно превышает сопротивление двух других стадий, то эффективная константа скорости с достаточно хорошим приближением будет равна константе скорости этой стадии. Эта стадия называется лимитирующей (или скорость определяющей) и характеризуется следующими особенностями:
- обладает максимальным сопротивлением и, следовательно, минимальным коэффициентом интенсивности в уравнении скорости (k, β или β ');
- на лимитирующей стадии происходит максимально возможное изменение концентрации газообразного реагента от CU до нуля (для необратимых реакций) или от CU до CU* (для обратимых реакций);
Гетерогенные
процессы протекают в кинетической
области,
если велика
скорость массообмена и
относительно мала
скорость химической реакции.
Для кинетической области характерно
сильное
влияние температуры
на скорость процесса (энергия активации
для большинства реакций достаточно
велика и составляет 40 - 280 кДж/моль). Это
обычно бывает при низких температурах
и давлениях, больших скоростях газового
потока и при высокой пористости или
отсутствии слоя «золы» (для процессов
с участием твердых реагентов, например,
различные виды обжига и выщелачивания).
При этом β>> k, β ' >> k и r
 k CU
(для реакций первого порядка).
k CU
(для реакций первого порядка).
Для интенсификации процесса необходимо повышать температуру (если наблюдаемая энергия активации имеет положительную величину) и концентрации (парциальные давления) реагентов.
Если скорость процесса массопереноса из потока к поверхности значительно меньше скорости химической реакции и внутренней диффузии, то процесс протекает во внешней диффузионной области. Величина энергии активации составляет 8-20 кДж/моль. При этом β << k, β << β '. Для интенсификации процессов, протекающих во внешнедиффузионной области, необходимо увеличивать скорость потока, а также проводить процесс при интенсивном перемешивании.
Если выполняются условия β ’ << k, β ' << β, процесс лимитируется внутридиффузионным торможением. Увеличение скорости внутренней диффузии возможно, главным образом, за счет уменьшения размера зерна катализатора (или частиц твердого реагента, участвующего в процессе).
В переходной области наблюдается примерно одинаковое влияние кинетики химической реакции и процессов массопереноса на скорость гетерогенного процесса, а коэффициенты интенсивности k, β и β ' и, соответственно, сопротивления на каждой стадии соизмеримы по величине.
Как следует из экспериментальных данных, образование формальдегида на серебряном катализаторе при линейной скорости газового потока W = 2 м/сек и температурах ниже 300 ОС протекает в кинетической области, при 300 - 500 ОС – в переходной и выше 500 ОС - во внешнедиффузионной области.
-
Промышленный катализ. Виды катализа. Свойства катализаторов и их классификация. Гетерогенно-каталитические процессы. Стадии гетерогенно-каталитического процесса. Технологические характеристики твердых катализаторов и требования, предъявляемые к ним. Способы изготовления катализаторов. Понятие о гомогенном катализе.
Катализаторы — это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции. Они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.

Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0
А+В~ R.
Ход реакции на энергетической диаграмме изображен кривой 2. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 1). Например, первой стадией может быть образование промежуточного активированного комплекса АК:
А+ К~ АК
(здесь К- катализатор). Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
АК+ В~ RК.
Последней стадией является разложение комплекса RК с образованием продукта R и высвобождением катализатора для нового каталитического цикла:
RК = R + К.
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3 (кривая 2), но высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное и конечное энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми. Следовательно, катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Катализатор может увеличивать скорость только тех процессов, которые разрешены термодинамически, но не может инициировать реакции, протекание которых невозможно при данных условиях в соответствии с законами химической термодинамики.
Некоторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах. В качестве примера синтеза аммиака.
В подавляющем большинстве промышленных ХТП используют катализаторы. Функция катализатора – селективное ускорение основной реакции. Как правило, катализатор обеспечивает возможность снижения наблюдаемой энергии активации и, вследствие этого, ускорение основной реакции при той же температуре или возможность снизить температуру (и тем самым подавить побочные реакции) при сохранении приемлемого значения скорости образования целевого продукта.
Тип катализатора и его характеристики определяют, как правило, выбор условий и показатели ХТП. В связи с этим ХТП делят на каталитические и некаталитические.
А каталитические ХТП подразделяют в зависимости от типа используемого катализатора на гомогенно - каталитические (катализатор находится в той же газовой или, чаще, жидкой фазе, в которой находятся реагенты и протекает каталитический процесс) и гетерогенно-каталитические. В гетерогенно-каталитических процессах используют твердые (гетерогенные) катализаторы, а реагенты находятся в газообразном или жидком состоянии.
Процесс протекает на поверхности катализатора.
Твердые катализаторы — это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Активность катализатора - мера ускоряющего воздействия по отношению к данной реакции.
Количественным критерием активности катализатора может служить константа скорости, измеренная для разных катализаторов в сопоставимых условиях (стандартных). Такой подход применим, если для всех сравниваемых катализаторов данной группы остается одинаковым порядок реакции.
Температура зажигания — это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
Пористая структура характеризует размеры и формы пор, пористость (отношением свободного объема пор к общему объему), удельную поверхность катализатора (т. с. приходящейся на единицу массы или объема).
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором- об отравлении катализатора.
некоторые участки катализатора обладают определенным энергетическим и геометрическим соответствием реагирующим молекулам - активные центры.
При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается.
основные стадии процесса взаимодействия газообразного реагента с зерном пористого катализатора:
-
Как и в гетерогенном некаталитическом процессе, сначала происходит диффузия газообразного реагента из основного потока к внешней поверхности зерна катализатора через газовую пленку, в которой концентрация реагента ниже, а концентрация продукта выше, чем в основном потоке. Эту стадию можно назвать стадией внешней диффузии.
-
Основная часть молекул газообразного реагента диффундирует внутри пор катализатора (стадия внутренней диффузии). Различают объемное (свободное) течение газов, течение Кнудсена и вынужденное течение. Все эти виды диффузии можно описать уравнениями молекулярной диффузии (законы Фика).
-
Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию (основная для каталитических процессов) в зависимости от природы сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела.
-
Вслед за адсорбцией происходит собственно поверхностная химическая реакция, которая заключается либо в перегруппировка активированного комплекса адсорбции, либо во взаимодействии одного адсорбированного реагента с молекулами другого. Механизм этой реакции может быть различным; от него зависит и вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт.
-
Следующим этапом процесса является десорбция продукта с поверхности катали затора. На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений.
-
Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора (обратная внутренняя диффузия).
-
Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора.
