
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Зависимость константы скорости элементарной реакции от температуры
При логарифмировании уравнения Аррениуса получаем:

График линейной
зависимости lnk от
 ,
коэффициентами которой являются lnA и -
,
коэффициентами которой являются lnA и -
 .
.

Из рис. очевидно, что при высоких температурах больше константа скорости той реакции, у которой энергия активации больше (если линии пересекаются).
При низких температурах больше константа скорости реакции с меньшей энергией активации.
Тангенс угла
наклона линейной зависимости lnk от
 равен
соответственно tgα = -
равен
соответственно tgα = -
 .
.
Следует иметь в виду, что в некоторых случаях величина предэкспоненциального множителя А также зависит от температуры, и поэтому влияние температуры на скорость химической реакции будет определяться не только величиной энергии активации, а совокупностью значений Е и А.
Необходимо подчеркнуть, что уравнение Аррениуса в строгом смысле справедливо только для элементарных реакций, когда энергия активации характеризует энергетический барьер на энергетической диаграмме реакции.
Для сложной по механизму реакции наблюдаемая энергия активации не имеет простого физического смысла и является просто температурным коэффициентом в уравнении Аррениуса. Зависимость наблюдаемой константы скорости (kэфф) от температуры для сложных реакций может описываться уравнением, по форме совпадающим с уравнением Аррениуса, но значения предэкспоненты и энергии активации могут быть любыми (в отличие от определенного диапазона значений этих параметров, характерных для элементарных реакций). Например, наблюдаемая энергия активации сложной реакции может быть отрицательна, т.е. скорость сложной реакции может уменьшаться с увеличением температуры из-за того, что в kэфф входят константы равновесия экзотермических стадий (реакций), значения которых уменьшаются с увеличением температуры.
-
Зависимость константы скорости от концентрации.
С точки зрения организации ХТП кинетические порядки основной и побочных реакций по реагентам важны, так как они отражают степень чувствительности скоростей образования целевых и побочных продуктов к изменению концентраций (парциальных давлений) веществ – участников ХТП. Чем выше порядок по данному веществу, тем сильнее влияет изменение его концентрации на скорость.
-
Зависимость дифференциальной селективности от концентраций реагирующих веществ
В зависимости от порядков по определенному реагенту для основной и побочных реакций можно влиять на селективность процесса.
Введем понятие дифференциальной селективности: φ΄. Она показывает отношение скорости превращения реагента по основной реакции в целевой продукт к общей скорости превращения реагента в текущий момент времени.
Рассмотрим простейший пример. В системе протекают две реакции:
основная: А → R (целевой продукт), константа скорости реакции k1, порядок реакции n1.
побочная: А → S (побочный), константа скорости реакции k2, порядок реакции n2.
Скорость превращения реагента А в целевой продукт R:

Скорость превращения реагента А в побочный продукт S:

Тогда, φ΄ равна отношению скорости превращения реагента А в целевой продукт R, к суммарной скорости превращения реагента А в целевой R и побочный продукт S:

Делим числитель
и знаменатель на величину k1∙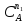 и получаем:
и получаем:

Если порядок основной реакции по реагенту больше, чем порядок по данному реагенту в побочной реакции (n1 > n2), то с увеличением концентрации реагента А дифференциальная селективность тоже возрастает:
Если порядок основной реакции по реагенту меньше, чем порядок по данному реагенту в побочной реакции (n1 < n2), то с увеличением концентрации реагента А дифференциальная селективность будет уменьшаться.
