
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Понятие элементарной реакции
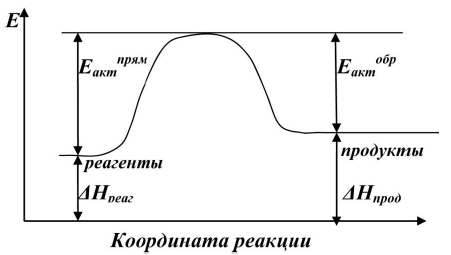
Элементарной реакцией (элементарной стадией) называют совокупность одинаковых элементарных актов химического взаимодействия.
Под элементарным актом химического взаимодействия понимают превращение одной или нескольких молекул, в ходе которого система преодолевает один энергетический барьер в одном направлении. Промежуточных продуктов при этом не образуется. Высшая точка на энергетической кривой соответствует переходному состоянию от исходных веществ к конечным веществам. Это состояние называют также активированным комплексом.

Отметим, что ΔНх.р. = Еакт. прям. - Еакт. обр.
Для данного случая (рис. 3.2) ΔНх.р.˂ 0, реакция экзотермическая.
-
Простые по механизму и стехиометрически простые реакции
Простая по механизму реакция состоит из двух элементарных реакций, протекающих в противоположных направлениях, и, так же как элементарная стадия, не имеет промежуточных соединений. Превращение в прямом и обратном направлении в простой реакции происходит через одно переходное состояние. Элементарные и простые по механизму реакции в «чистом виде» встречаются редко.
Если превращения в системе можно описать одним уравнением, то говорят о стехиометрически простой реакции. По существу, реакция может проходить через какие-то промежуточные стадии, но если в условиях данного процесса концентрации промежуточных продуктов малы, и они не учитываются в материальном балансе, то реакция будет считаться стехиометрически простой (все превращения в системе описываются одним уравнением).
Энергетическая диаграмма подобной стехиометрически простой, но сложной по механизму реакции может выглядеть следующим образом.

Стехиометрическое уравнение этой реакции: А + В + С = Р
-
Скорость химической реакции.
Скорость химической
реакции по i –тому веществу (ri)
в гомогенной системе определяется как
количество
вещества,
реагирующее или образующееся в
единицу времени в единице объема фазы
V, в которой
происходит химическое превращение (при
V = const):
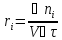
Для реагентов производная - отрицательна, а для продуктов – положительная, ni - количество молей вещества, τ - время.

Для процессов,
протекающих при постоянном объеме в
закрытой
системе:
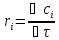 ,
где сi
– молярная концентрация вещества,
моль/л.
,
где сi
– молярная концентрация вещества,
моль/л.
Скорость реакции является функцией параметров системы: давления, концентраций реагентов, продуктов, катализатора, если он есть, и температуры.
Для систем при постоянном объеме эти параметры связаны между собой так, что давление является вполне определенным, если заданы температура и концентрации компонентов.
Элементарную реакцию от сложной (по механизму) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции может быть описана законом действия масс. Для реакции (аА + вВ → сС + dD) уравнение:

Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции.
-
Зависимость скорости от температуры.
Зависимость константы скорости элементарной реакции от температуры описывают уравнением Аррениуса.

где А – предэкспоненциальный член, Е – энергия активации, R – газовая постоянная, Т – абсолютная температура.
Энергия активации равна той избыточной энергии, которой должны обладать молекулы, чтобы они могли прореагировать друг с другом. Величина энергии активации соответствует энергетическому барьеру как для прямой – Епрям, так и для обратной реакции – Еобр.
В случае экзотермической реакции Епрям. < Еобр. Для эндотермической реакции соответственно наоборот.
 Эндотермическая
Эндотермическая
